背景介绍
1、EMT的分类与诱因
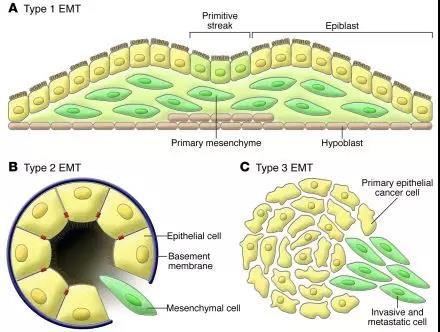
EMT主要分为以下三种类型,如图1:
>>>>1)生物发育过程中的EMT:
在胚胎早期发育过程中,一些上皮细胞通过EMT和它的逆反应,即间质—上皮转化(mesenchymal-epithelial transitions,MET)完成组织或器官的发育,如原肠胚、心瓣膜以及神经嵴的形成;
>>>>2)纤维化进程中的EMT:
在组织损伤的修复过程中,通过产生成纤维细胞来修复由创伤或者炎症反应造成的组织或器官的损伤;
>>>>3)肿瘤迁移中的EMT:
参与肿瘤的发生、发展过程中,上皮细胞来源的肿瘤细胞EMT后获得运动和侵袭能力,再经血液、淋巴循环向远端转移。
研究表明,多种信号都能够触发EMT过程,比如生长因子、肿瘤细胞与间质细胞间的相互作用,microRNA以及肿瘤微环境(例如:缺氧)等信号。
Picture from Kalluri R, Weinberg RA. J Clin Invest. 2009;119(6):1420–1428.
2、EMT发生的常见标志分子与相关信号通路
EMT过程通常都是在上皮细胞中发生的,该过程可以由多种信号诱导触发,其中尤以组成正常组织或肿瘤新生物组织(neoplastic tissue)的间质细胞所释放的信号作用最为突出。转化生长因子β家族(TGFβ)成员是所有能诱导胚胎发育过程里EMT转换过程的细胞因子中最重要,也是被研究得最透彻的一大类细胞因子,它们可以治疗纤维变性性疾病(fibrotic diseases)和肿瘤性疾病。TGFβ信号能够通过多个不同的信号机制诱发EMT转换过程,比如通过直接磷酸化SMAD转录因子配体活化受体(ligand-activated receptors of SMAD transcription factor)的途径(详情请点击往期推文:Smads家族蛋白如何精准调控TGF-β信号转导),以及通过某些能够调控细胞极性和细胞间紧密连接形成过程的胞质蛋白来触发EMT转换过程。TGFβ还能影响其它多个EMT触发信号途径的活性,比如Notch、Wnt以及整联蛋白信号通路等。Wnt信号通路能通过抑制糖原合成酶激酶3β(glycogen synthase kinase -3β,GSK3β)介导的磷酸化作用以及抑制胞质中的β连环蛋白(β-catenin)降解等作用来诱发EMT转换(详情请点击往期推文:一篇文章带你读懂什么是Wnt/β-Catenin信号通路)。Notch信号通路也能诱发EMT过程,它主要是通过激活NF-κB信号通路或者调控TGFβ信号通路的活性来发挥作用。
缺氧(Hypoxia)(详情请点击往期推文:HIF通路凭啥能获诺贝尔奖?)也是一种能够诱发EMT过程的生理机制,它也是通过多种机制,比如上调缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF1α)、肝细胞生长因子(hepatocytegrowth factor,HGF)、SNAI1以及TWIST1等蛋白的表达,激活Notch或NF-κB信号通路,以及诱导DNA甲基化等作用机制来诱发EMT过程的。大量的酪氨酸蛋白激酶受体(receptor tyrosine kinases,RTK)也通过PI3K/AKI和Ras-Raf-MAPK通路激活EMT在相关的胚胎发育过程中的重要作用,比如胚胎分支形态发生过程(branching morphogenesis)和胚胎心脏瓣膜形成过程(cardiac valve formation)等。(见图2)
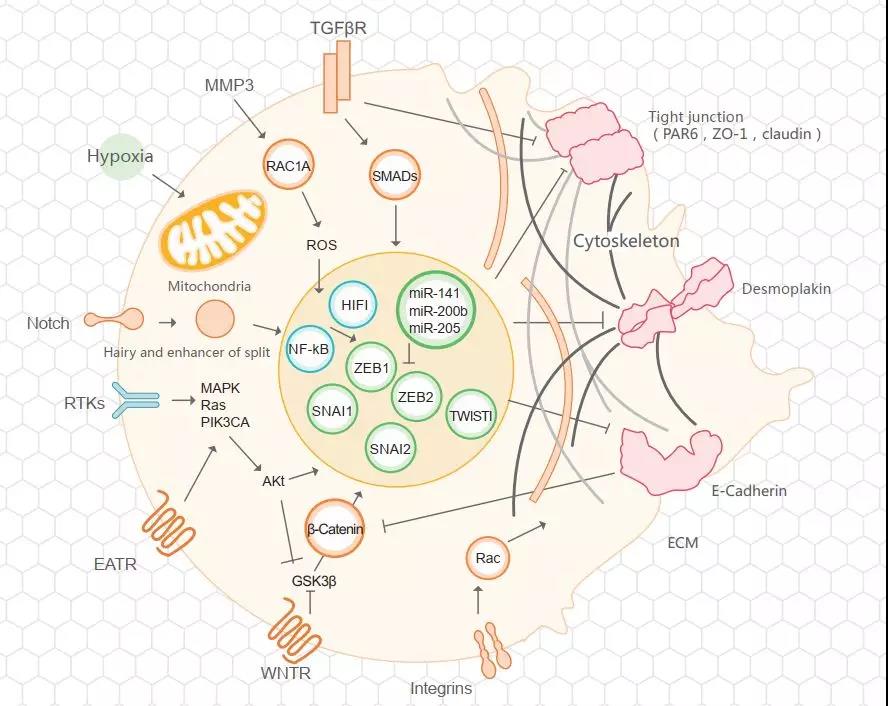
图2. EMT相关的信号通路(Picture from ABclonal)
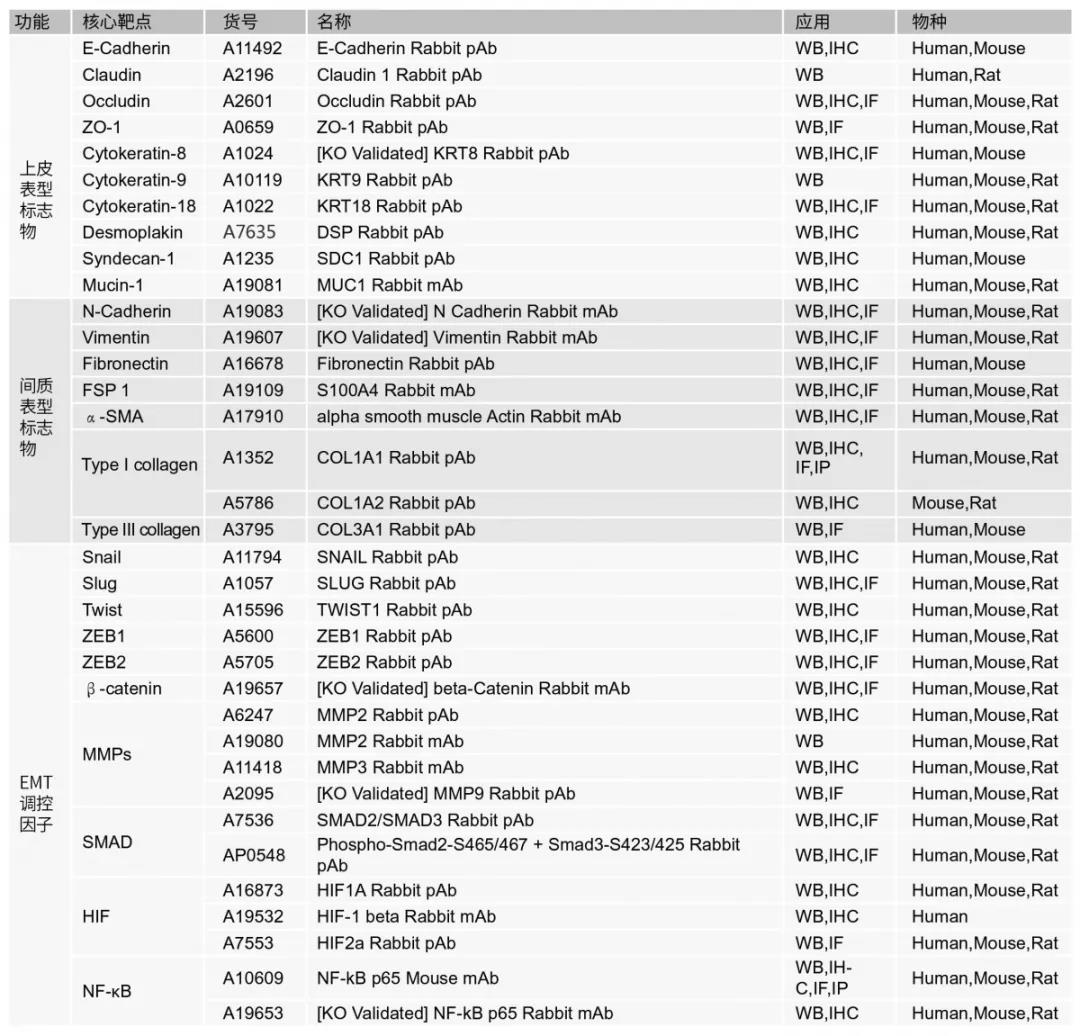
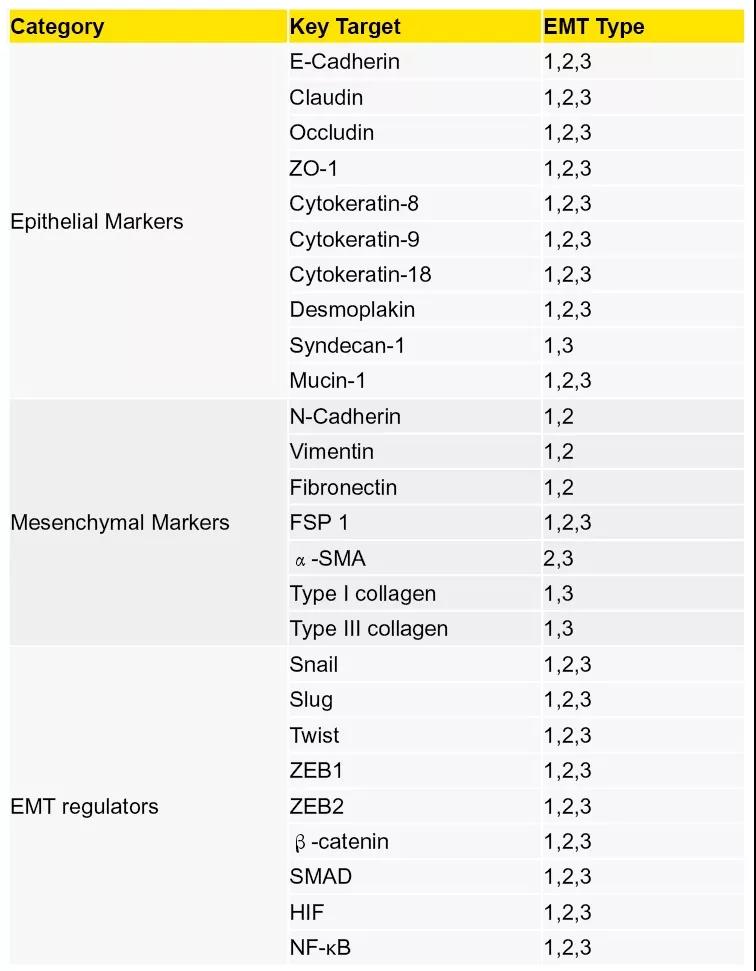
>>>>EMT中涉及到的重要靶点表达水平变化整理如下:
✦1.表达减少:E- cadherin,Cytokeratin,Claudin, ZO-1
✦2.表达增多:N- cadherin,Vimentin,Snail1,Snail2,FN,α-SMA, Twist,MMP-2,MMP-3,MMP-9
✦3.活性增加:ILK,Rho
EMT的程序性激活可使肿瘤细胞获得特殊的转移能力产生循环肿瘤细胞( circulating tumor cells, CTCs),这和胚胎发育时期,上皮状态和间充质状态的细胞能够自由转化有极大的相似性。CTCs在经过血液循环传播后,发生间质上皮转化(mesenchymal-epithelial transition, MET)最终形成继发性转移病灶,在身体另一个部位产生新的肿瘤。(见图3)
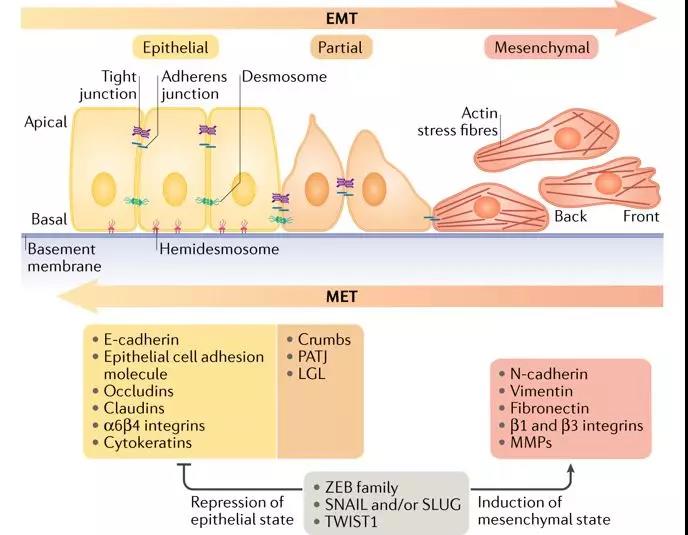
图3:图解EMT分子标记物
Picture from: Dongre, A., Weinberg, R.A. Nat Rev Mol Cell Biol 20, 69–84 (2019)
按照分子标志物涉及到的EMT类型和对应功能,对他们的分类如下(见表1):
3、未来EMT研究热点
由于EMT和肿瘤浸润和迁移的这种紧密联系,现在的科研工作者们都致力于根据EMT背后的分子机制去攻克癌症扩散的难关。在这里,小编根据最新的EMT研究进展,点出了一些尚未攻克的难关,给各位奋斗在科研一线的小伙伴一些参考!
A)由于EMT的机制非常复杂,涉及到的信号通路有胞内和胞外,但是不同的信号通路之间是否会有相互作用,共同影响EMT的发生尚不清楚;
B)EMT的诱导因子众多,不同部位的肿瘤对应的决定性诱导因子将成为靶向治疗的关键;
C)肿瘤细胞的迁移也分为多个阶段,EMT和MET在他们不同阶段担任的角色是否都一样呢?
D)EMT涉及到了很多的调控因子,这些调控因子的研究目前多数还停留在单一功能阶段,而调控因子之间的互作往往有牵一发而动全身的可能;
E)针对肿瘤的临床诊断上,部分关键靶点的表达水平变化如何与机体自身的EMT导致的变化做区分,综合哪些靶点可以精准定位一个病灶的状态也是亟待解决的问题。
F)短发卡RNA引起的Snail基因表达沉默能够逆转EMT,并对体内肿瘤的生长也有抑制作用,miRNA和EMT的关系也越来越多被大家提起,针对miRNA去抑制肿瘤生长也是一个新思路;
G)最后,肿瘤治疗中的耐药性问题也是一个技术难关,EMT是一个可逆过程,加深调控因子的研究是否可以解决耐药性的难题。
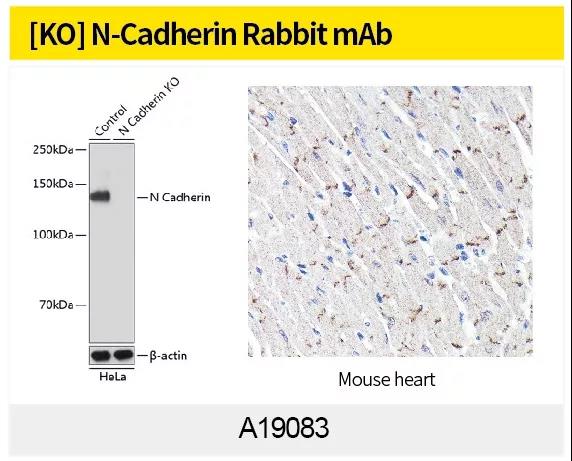
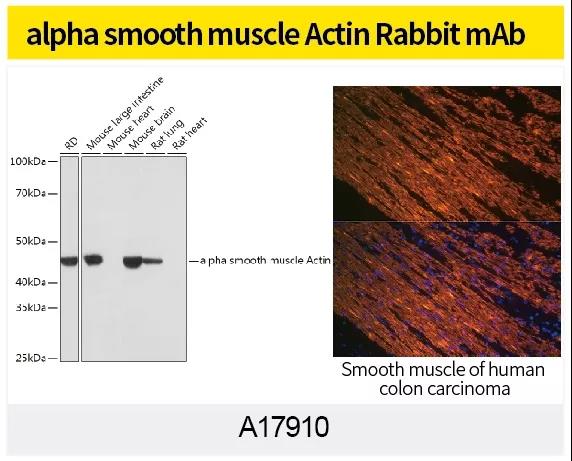
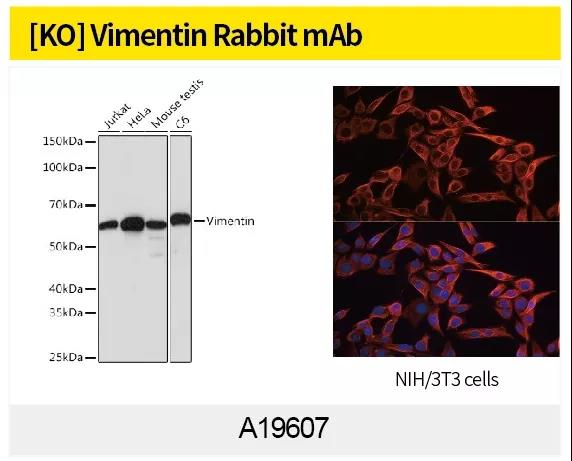
最常用证明 EMT 的办法是观察形态或 WB、IHC、IF或qPCR 检测细胞 E-cadherin,N-cadherin,Vimentin 等 EMT marker 蛋白表达量变化。ABclonal针对EMT信号通路研究,利用第四代重组兔单抗技术(图4)制备了N-Cadherin (A19083),alpha smooth muscle Actin Rabbit mAb (A17910),Vimentin(货号A19607)和beta Catenin(货号A19657)等高质量重组兔单抗。
ABclonal第四代重组兔单克隆抗体制备采用创新的细胞分选、富集、生物信息学和重组单克隆抗体技术,直接从B细胞中获得理想的兔单克隆抗体。ABclonal在加强自身抗体升级的同时,也可对外承接兔单抗定制服务。
4、案例展示
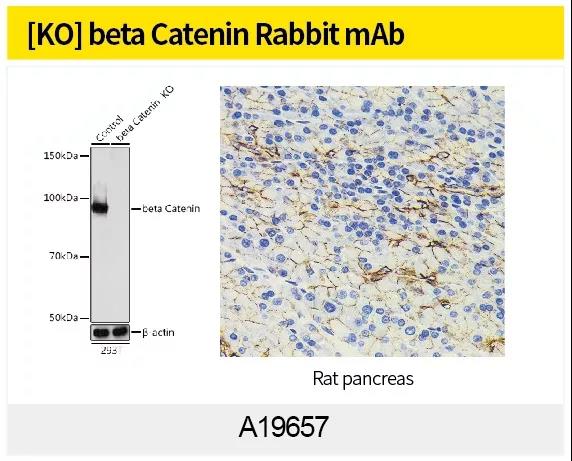
5、EMT相关产品列表