导读
肿瘤细胞的快速增殖不仅带来生化微环境的改变,也会对肿瘤的力学微环境造成影响。这些影响包括增加细胞外基质硬度[1, 2]、增大细胞间的机械挤压[3]以及组织渗透压[4]等。
肿瘤力学微环境的改变又能反调节肿瘤细胞的增殖和转移。在肿瘤发生转移时,细胞突破基底膜进入血液循环系统或腹腔环境中。由于缺乏与细胞外基质的黏附,这类肿瘤细胞所处环境的基质硬度和力学信号大大减弱,易诱发失巢凋亡。
有研究报道,在失黏附情况下,肿瘤细胞的代谢通路和自噬水平发生改变,肿瘤抵抗失巢凋亡的能力增加,这提示细胞代谢过程参与调节肿瘤细胞存活[5, 6]。然而目前的肿瘤治疗方案主要集中在免疫检查点、靶向血管新生等方面,对力学信号调节的细胞代谢重塑缺少研究。从生物力学和细胞代谢的新角度出发,探究肿瘤的发生发展和抗死亡机制,具有重要的临床意义。
研究背景
院吴聪颖课题组在Advanced Science(IF=15.1)在线发表文章“mTORC1 mediates biphasic mechano-response to orchestrate adhesion-dependent cell growth and anoikis resistance”( mTORC1通过介导细胞的双面力学感知能力促进细胞增殖并抵抗失巢凋亡)。

2023年12月2日,北京大学基础医学揭示了机械力信号通过黏着斑调控mTORC1通路的分子机制,并阐明了该机制在促进肿瘤细胞原位增殖和远端转移中的作用。
研究成果
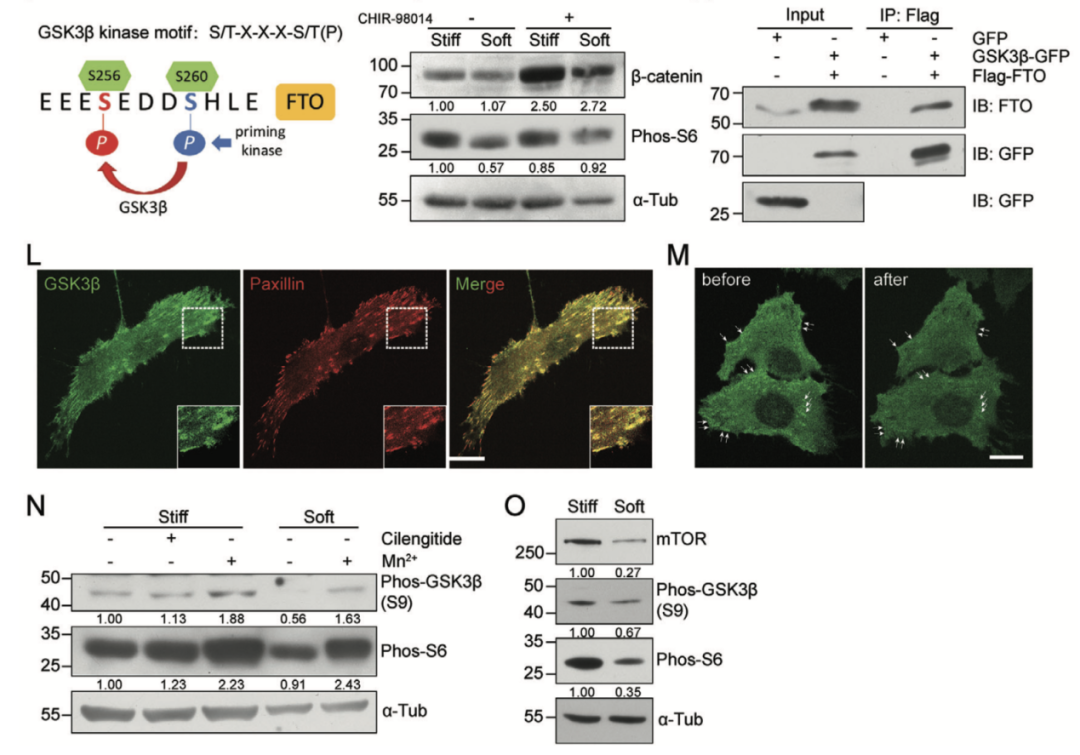
01、mTORC1通路参与基底硬度对细胞增殖的调控
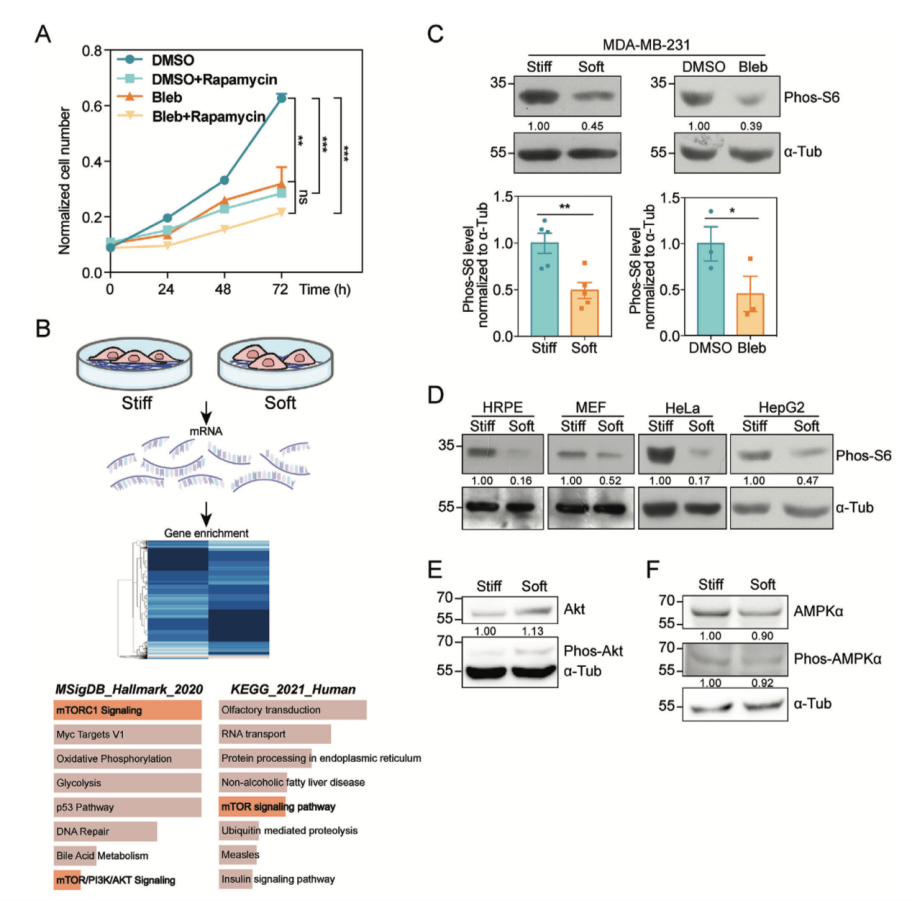
通过将丙烯酰胺和甲叉双丙烯酰胺溶液进行不同比例的混合,得到具有不同硬度的聚丙烯酰胺水凝胶。作者发现细胞在软基底(4 kPa)上的增殖速率显著低于硬基底(GPa),说明基底硬度能够调节肿瘤细胞的增殖速率。
通过转录组测序,作者筛选到mTORC1通路在硬基底上调,提示mTORC1通路的激活可能是造成硬基底上细胞增殖优势的原因。作者发现,硬基底上生长的细胞phos-S6相较于软基底上生长的细胞显著上调,而S6总蛋白水平在不同硬度基底上没有差异,表明细胞收缩力和基底硬度影响mTORC1通路的活化。
02、基底硬度通过整合素和黏着斑活化mTORC1
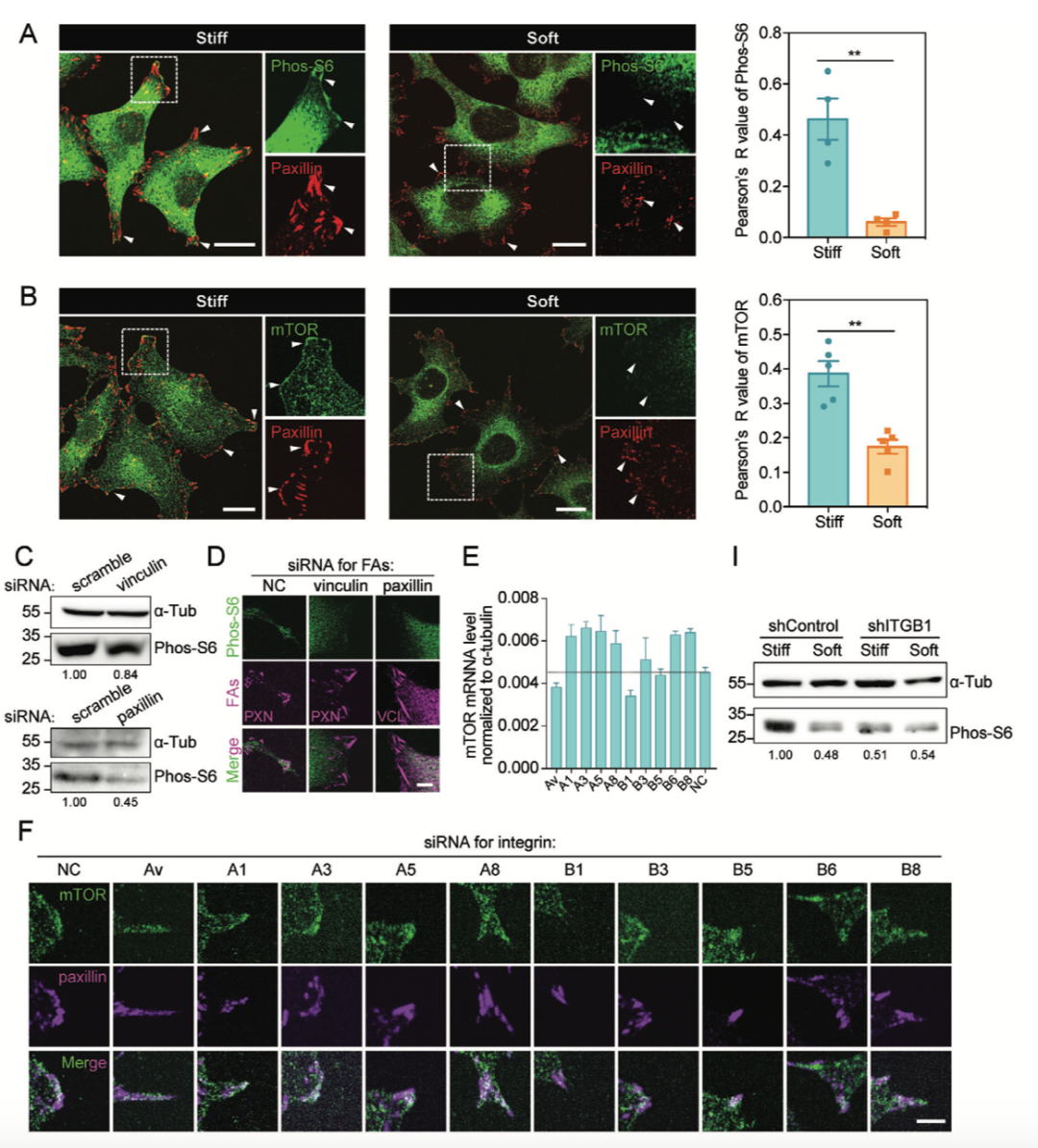
mTORC1通路响应基底硬度调节细胞增殖,然而具体的分子机制还不清楚。整合素和黏着斑是细胞感知并传导机械力信号的重要分子,作者对不同硬度基底上的细胞进行染色发现,硬基底上细胞的mTOR和phos-S6蛋白与黏着斑蛋白Paxillin共定位;而在软基底上生长的细胞中共定位消失。
黏着斑与细胞外基质进行连接的重要结构是整合素。作者对10种最为常见的整合素进行敲低并发现,敲低整合素β1之后,mTOR的蛋白丰度、phos-S6水平和mRNA水平都发生了显著降低。这些结果说明整合素β1参与基底硬度对mTORC1活性的调节。
03、基底硬度调节mTOR的转录本稳定性和蛋白丰度
作者接下来探究了基底硬度对mTORC1通路调控的具体机制。mTORC1复合体由众多亚基蛋白构成,作者发现mTOR的蛋白水平在软基底上显著降低,蛋白合成过程受抑制。
作者使用放线菌素D(actinomycin D)抑制mRNA 的合成过程,并观察到与对照组相比,blebbistatin处理组的细胞中mTOR转录本水平随时间下降更加显著,提示细胞收缩力的减弱破坏了mTOR的mRNA稳定性,导致mTOR蛋白丰度的改变。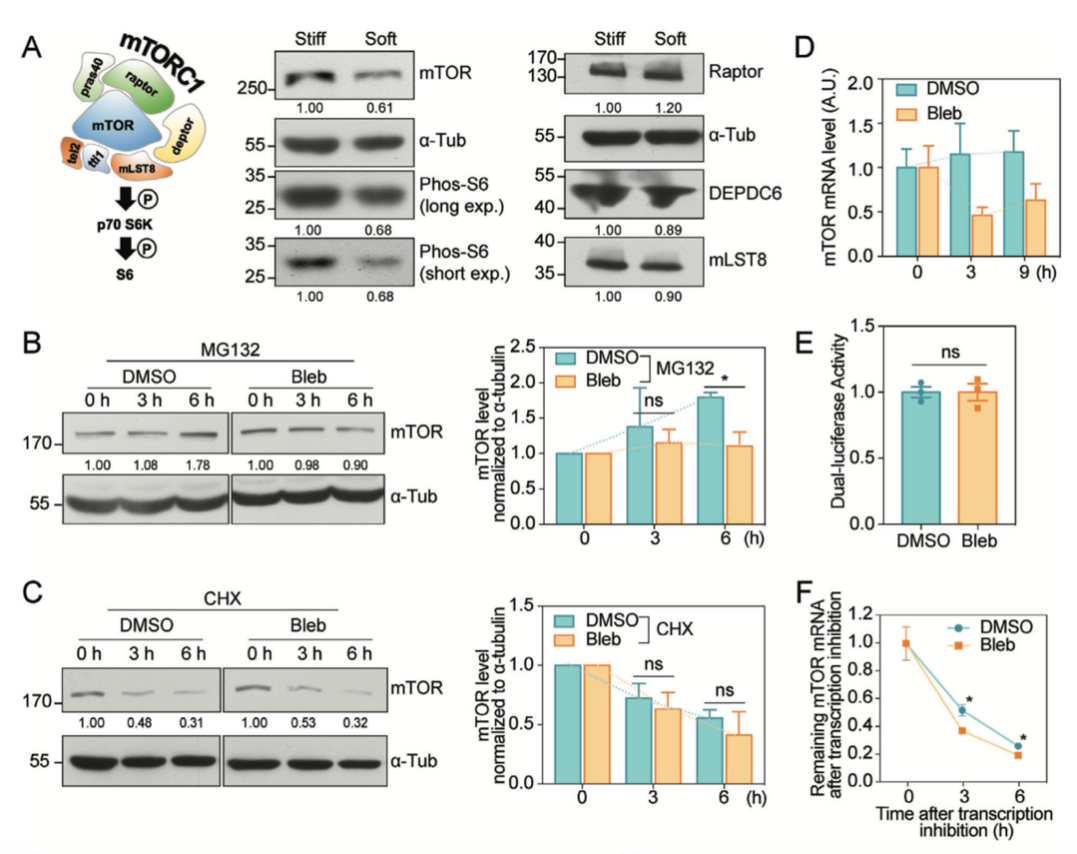
04、基底硬度通过FTO调节mTOR转录本的m6A修饰
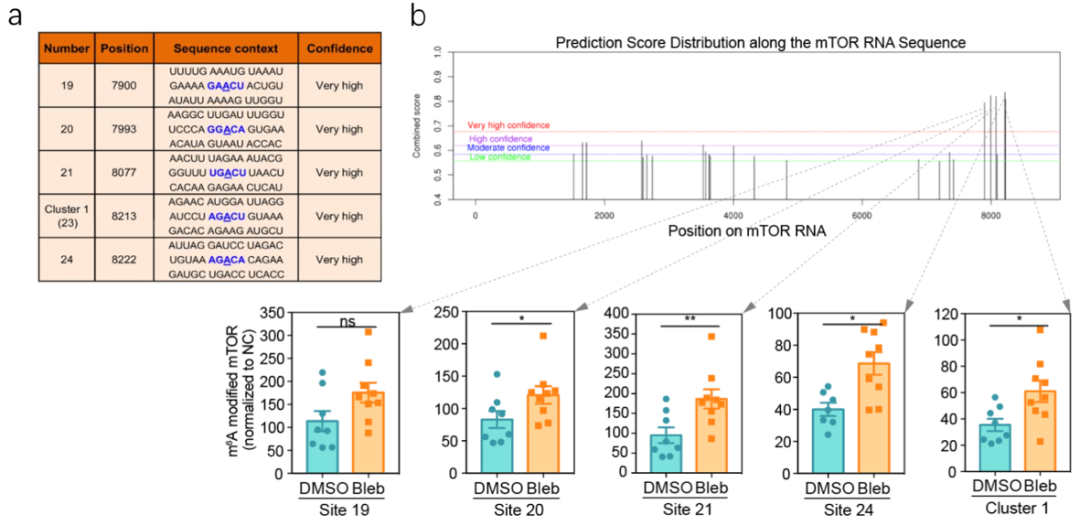
m6A修饰通过影响mRNA稳定性及后续的翻译过程来调控诸多细胞生命活动,因此作者探究了m6A修饰是否参与mTOR蛋白丰度的调节。
对细胞进行m6A-qPCR检测,作者发现blebbistatin处理后这五个潜在位点的m6A修饰水平均升高,说明m6A修饰可能介导了力学信号对mTOR转录本稳定性的调节,由此改变了mTORC1复合体中核心激酶mTOR的丰度,影响mTORC1通路活性。
m6A修饰作为一个可逆的过程,包括多种效应分子,其中“writer”和“eraser”蛋白负责m6A甲基化修饰的写入和擦除,而“reader”主要负责读取信号并执行功能。作者发现在“eraser”蛋白FTO敲除后,软硬基底上细胞中的phos-S6水平均下降,并不再响应基底硬度,证实了机械力通过FTO通过介导m6A擦除参与基底硬度对mTOR转录本稳定性调节。
有研究发现,FTO蛋白的Ser256位点的磷酸化可以抑制其去甲基化酶活性,作者构建了模拟Ser256位点持续处于磷酸化状态的FTO突变体S256D,并发现与回补野生型FTO不同,对FTO敲除细胞回补S256D突变体后细胞的mTOR和phos-S6水平在软硬基底之间没有差异,不再响应基底硬度,说明基底硬度可能通过Ser256位点的磷酸化调控mTORC1通路。
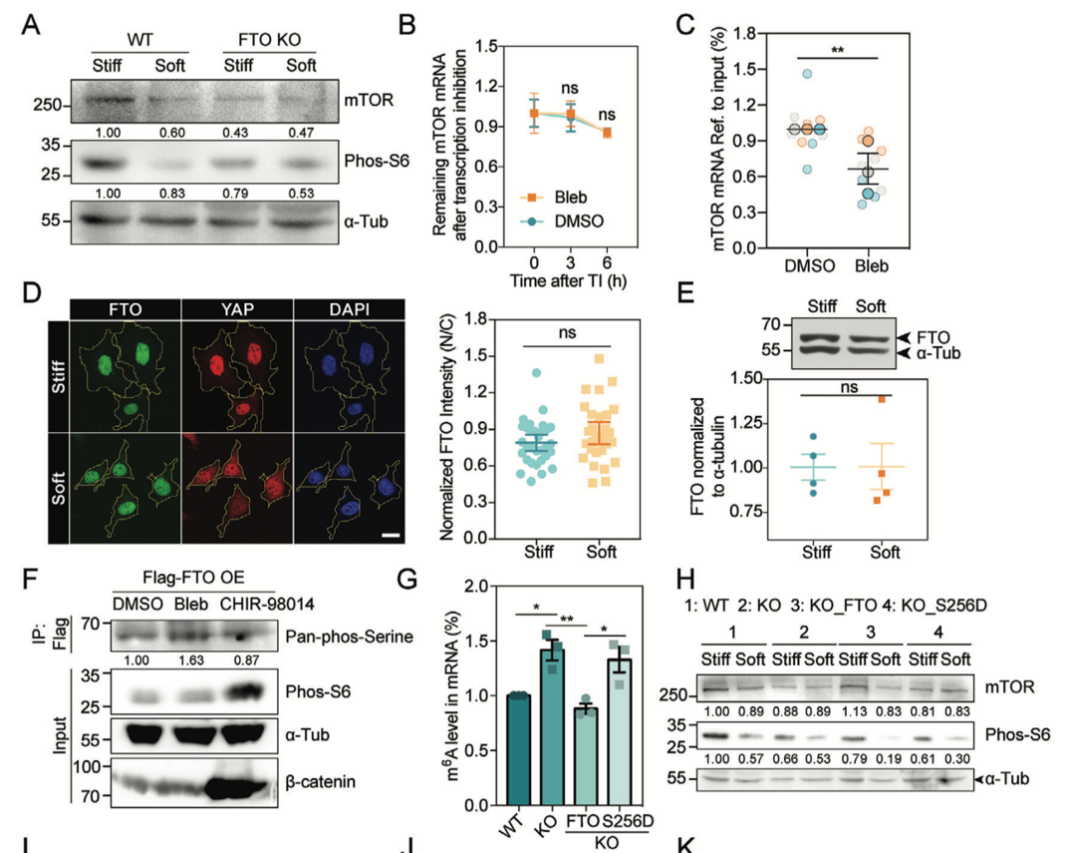
05、GSK3β感知基底硬度调节FTO磷酸化水平及活性
作者通过免疫共沉淀联合质谱技术寻找FTO的相互作用蛋白,发现糖原合成激酶3-GSK3β能够与FTO发生互作。进一步作者观察到GSK3β可以在细胞腹侧形成斑块样结构,且这些结构与黏着斑蛋白paxillin共定位。
作者发现在软基底上mTOR和phos-S6水平下降,并伴随着GSK3β的Ser9位点磷酸化水平下降,提示GSK3β的活化。通过CHIR-98014处理抑制GSK3β活性,作者发现FTO蛋白的丝氨酸磷酸化程度降低,而blebbistatin促进的GSK3β活化则导致了相反的实验结果。同时作者也发现,CHIR-98014处理能够挽救软基底细胞中phos-S6的蛋白水平。
综上所述,这些结果提出了基底硬度通过GSK3β影响FTO活性进而调控mTORC1通路的机制。
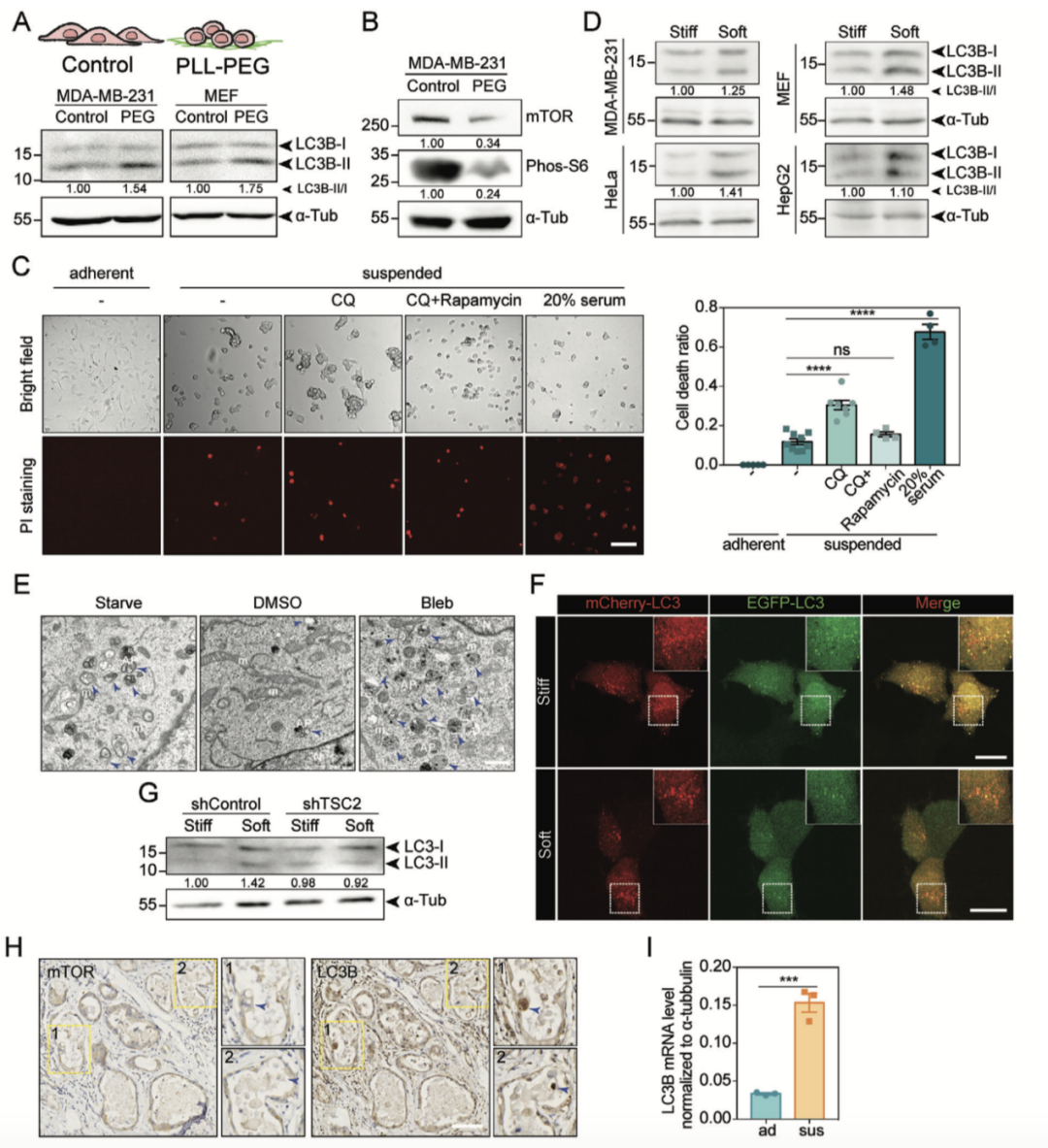
06、失黏附力学环境以mTORC1依赖的方式调节细胞自噬
考虑到mTORC1在自噬过程中的重要作用,接下来作者探索mTORC1是否参与基底硬度对自噬的调控。对硬基底上的细胞进行雷帕霉素处理抑制mTORC1活性后,作者发现基底硬度对自噬过程的调控是依赖于mTORC1通路的。
基底脱离(ECM detachment)相当于一种极端的软基底培养条件,这个过程会诱导细胞产生代谢应激,诱发细胞失巢凋亡。而自噬作为促细胞生存的机制,通过帮助细胞重新附着于基底,以保护细胞免于失巢凋亡。首先,作者通过孵育PLL-PEG使细胞处于类似于基底脱离的状态,发现自噬水平上调、mTOR和phos-S6的蛋白水平降低,提示基底脱离状态抑制mTORC1通路。
作者还发现与贴壁细胞相比,基底脱离会促进细胞死亡。当抑制自噬细胞死亡比例进一步增加,反之细胞死亡比例降低,说明抑制mTORC1活性可以上调自噬水平,保护细胞免受失巢凋亡。以上结论在人乳腺导管原位癌和哺乳期雌性小鼠的乳腺切片中得到了验证。
参考文献
[1] Fernández-Sánchez ME, Barbier S, Whitehead J, Béalle G, Michel A, Latorre-Ossa H, Rey C, Fouassier L, Claperon A, Brullé L, Girard E, Servant N, Rio-Frio T, Marie H, Lesieur S, Housset C, Gennisson JL, Tanter M, Ménager C, Fre S, Robine S,Farge E. Mechanical induction of the tumorigenic β-catenin pathway by tumour growth pressure. Nature. 2015, 523(7558): 92-95
[2] Nia HT, Liu H, Seano G, Datta M, Jones D, Rahbari N, Incio J, Chauhan VP, Jung K, Martin JD, Askoxylakis V, Padera TP, Fukumura D, Boucher Y, Hornicek FJ, Grodzinsky AJ, Baish JW, Munn LL,Jain RK. Solid stress and elastic energy as measures of tumour mechanopathology. Nat Biomed Eng. 2016, 1
[3] Gutmann R, Leunig M, Feyh J, Goetz AE, Messmer K, Kastenbauer E,Jain RK. Interstitial hypertension in head and neck tumors in patients: Correlation with tumor size. Cancer Res. 1992, 52(7): 1993-1995
[4] Heldin CH, Rubin K, Pietras K, Ostman A. High interstitial fluid pressure – an obstacle in cancer therapy. Nat Rev Cancer. 2004, 4(10): 806-813
[5] Chelakkot C, Yang H, Shin YK. Relevance of circulating tumor cells as predictive markers for cancer incidence and relapse. Pharmaceuticals (Basel). 2022, 15(1)
[6] Avivar-Valderas A, Salas E, Bobrovnikova-Marjon E, Diehl JA, Nagi C, Debnath J,Aguirre-Ghiso JA. Perk integrates autophagy and oxidative stress responses to promote survival during extracellular matrix detachment. Mol Cell Biol. 2011, 31(17): 3616-3629

