前言
“战疫”是一场人类与病毒的较量,也是一场科研与时间的赛跑。新型冠状病毒肺炎疫情来势凶猛,临床上亟须做出快速响应并找到有效的治疗方案。针对新型冠状病毒的新药开发是一个费时、费力、高投入和高风险的过程,显然短期内无法满足临床治疗的需求。因此,”老药新用”成了目前新冠肺炎药物开发的主流途径。
采用“老药新用”的研发策略,即进一步验证至少已经完成临床Ⅰ期的安全性有一定保证的药物,可以节省临床前和部分临床研究时间,大大缩短药物研发的时间成本,是针对突发性疾病、迅速缓解当前疫情最有效的药物研发手段。
理论上,病毒和人类蛋白质之间的任何交集都是药物可以对抗冠状病毒的地方。潜在的抗冠状病毒疗法可以分为两类:一类直接针对新型冠状病毒,另一类则以人体为导向。由于病毒必须进入宿主细胞内复制才能发挥功能,因而设计抗病毒药物时,可分别针对病毒侵入宿主细胞并完成生命周期时病毒与细胞受体相互作用、基因复制、转录及转译等过程中的一系列靶点进行研发。除了上述针对病毒进行药物研发之外,还可以以人体为导向,针对病毒引起的机体免疫反应寻找治疗药物。但是,新冠病毒在侵入人体后,会和哪些人类蛋白质相互作用呢?哪些蛋白已经成为相关药物的靶点了呢?
为了解决这一问题,来自美国加州大学Gladstone研究所的一个研究小组在人类细胞中克隆、标记和表达了26种SARS-CoV-2蛋白,并利用亲和纯化质谱(AP-MS)鉴定了与每种蛋白物理相关的人类蛋白质,鉴定了332种高度可信的与SARS-CoV-2相互作用的人类蛋白。通过生物信息学分析,该研究小组发现69种化合物(包括29种FDA批准的药物、12种临床试验药物和28种临床前化合物)有希望用于新冠肺炎的治疗。通过利用非洲绿色猴细胞代替人类细胞对这些潜在药物进行抗病毒测试,研究小组确定了两类显示抗病毒活性的药物:mRNA翻译抑制剂和SigmaR1/2受体的预测调节因子,该研究成果发表在《自然》杂志[1]。进一步研究这些新冠药物相关潜在蛋白靶点,会极大的加速新冠治疗药物的开发(见附表)。
在这里,我们将结合这篇Nature文献的数据及其他相关文献报道,对可能用于新冠治疗的已有药物相关靶点进行一个系统解读。
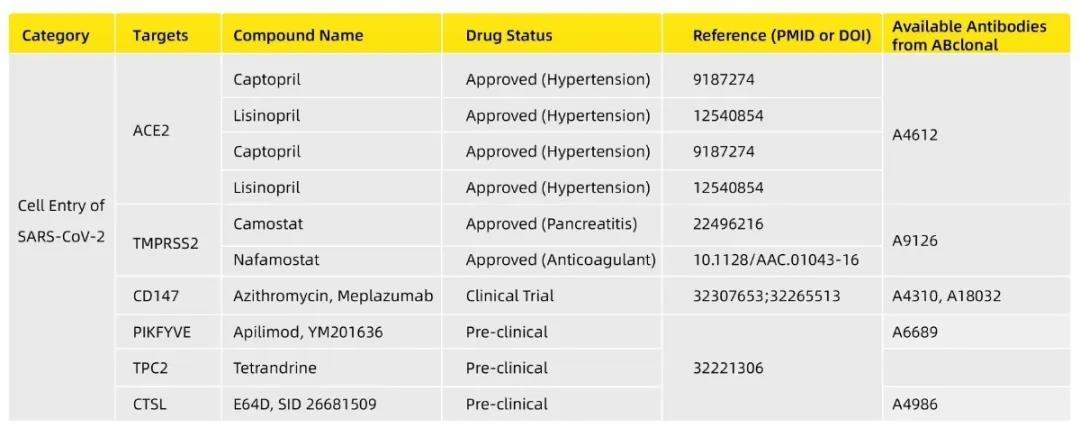
1、新冠病毒附着和进入宿主细胞的相关蛋白
通过新冠病毒结构分析,位于新冠病毒病毒颗粒最外层的S蛋白能够和宿主细胞上的相应受体ACE2结合进入细胞[2]。S蛋白由两个功能亚基组成:S1(负责识别/结合受体)和S2(负责膜融合),S1亚基(RBD区域)与ACE2受体蛋白的相应部位特异结合后,可以被具有蛋白酶活性的ACE2切割和激活,发生一系列的构象变化,暴露出膜融合肽(FP),S2亚基通过将FP插入宿主细胞膜而改变构象,两个七肽重复区(HR-N和HR-C)形成六螺旋束,将病毒包膜与细胞膜之间的距离拉近,最终导致病毒包膜和细胞膜融合。
因此,针对ACE2的药物研发或试验成为了科研人员关注的热点。除了ACE2,已经有不同报道表明,一些跨膜蛋白酶也会间接成为新冠感染早期阶段的相关干预靶点,比如可以参与ACE2与SARS-CoV-2膜融合过程的TMPRSS2就在这篇Nature的报道中提及,同时也有一些实验小组初步证实针对TMPRSS2的经过临床验证的抑制剂显示对病毒入侵的干预有效[3]。此外,还有CD147[4,5]、V-ATPase、PIKFYVE、TPC2和CSTL[6]等靶点被关注(如下表所示)。
2、新冠病毒复制相关RNA聚合酶和蛋白酶
已知新冠病毒由ORF1a、ORF1b、ORFS、ORFE、ORFM、ORFN、ORF3a、ORF6、ORF7a、ORF7b、ORF8和ORF10等10个亚基因组组成,冠状病毒在细胞内分解,将核衣壳和病毒遗传物质RNA释放到细胞质中,以该RNA为转录本,将ORF1a/b翻译成复制酶多聚体蛋白1a(pp1a)和pp1ab,pp1a和pp1ab被病毒蛋白酶PLpro和3CLpro裂解,产生15-16种具有各种功能的非结构蛋白nsp(nsp1-16):包括RNA聚合酶(RdRP)、木瓜蛋白酶样蛋白酶PLpro和主要蛋白酶Mpro活性和解旋酶在内的病毒聚合酶和蛋白酶,其中nsp12具有RNA聚合酶(RNA-dependent RNA Polymerase,RdRP)活性,nsp3具有木瓜蛋白酶样蛋白酶PLpro(负责切割nsp1/2,nsp2/3和nsp3/4边界)活性,nsp5具有3CL水解酶Mpro活性,而nsp3、4和6还诱导细胞膜重排,形成双膜囊泡或小泡结构,而这也正是冠状病毒复制-转录复物(RTC)组装和锚定位点。在冠状病毒复制-转录复合物RTC中,在复制酶的作用下,病毒基因组通过其独特的不连续性转录机制,以病毒基因组正链RNA为模板,生成全长的负链RNA;而以负链RNA为模板,又可合成新的基因组RNA。聚合酶还可在基因组的特定位点(转录调节序列)的不连续转录过程中切换模板,从而产生5’嵌套的反义亚基因组sgRNA,并以其为模板合成3’嵌套的正义sgRNAs(如图1所示)[7]。
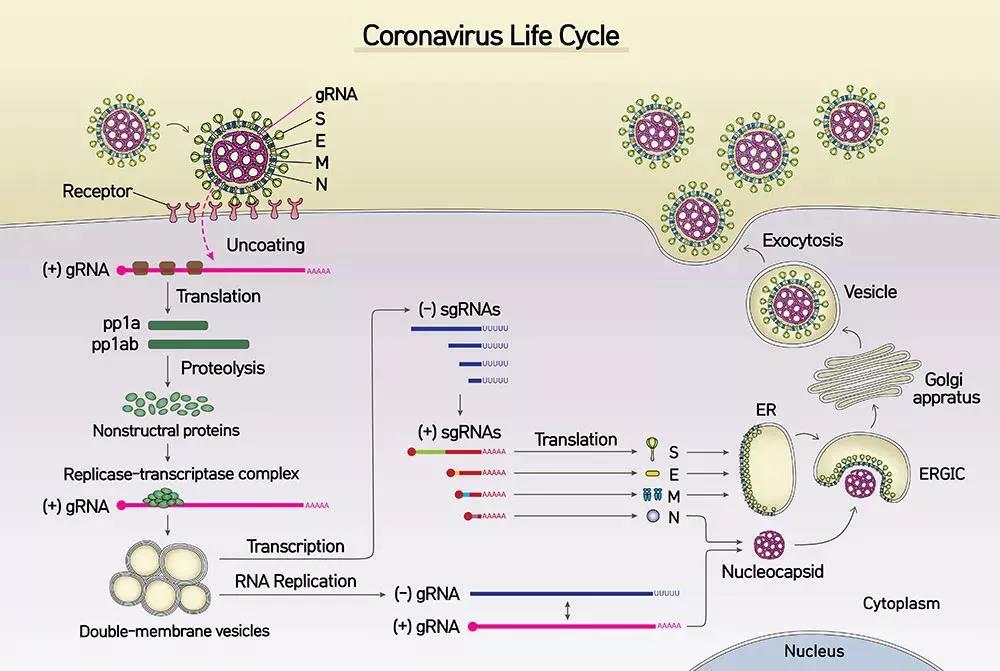
图1:冠状病毒的生活周期
目前,理论上可以作用于新冠RdRP的广谱抗病毒药物瑞德西韦的临床试验结果不理想,而另一个RdRP抑制剂药物法维拉韦临床疗效显著,作为首个新冠肺炎药物获批上市。而针对新冠蛋白酶的候选潜在已有抑制剂类药物往往是针对其他病毒的,如针对艾滋病毒研发的病毒蛋白酶抑制剂药物洛匹那韦/利托那韦片,对新冠病毒是否真的有效还需通过严谨的临床验证,必须谨慎使用。
3、翻译调节相关蛋白
新冠病毒亚基因组mRNAs还会翻译产生S、M、N和E等结构蛋白和辅助蛋白。大多数冠状病毒sgRNA是单顺反子,因此只有5′-最末端的ORF以帽依赖的方式翻译。但是,某些sgRNA也可以采用其他机制,例如核糖体渗漏扫描(ribosome leaky scanning)和核糖体内部进入(ribosome internal entry),来翻译其他ORF。跨膜结构蛋白(S,HE,M和E)和一些与膜相关的辅助蛋白在内质网ER中翻译,而N蛋白则通过胞质中游离核糖体翻译。
从这篇Nature文献的研究结果来看,对于宿主翻译机器的调控,可能成为新冠肺炎治疗药物选择或研发新的方向。
翻译周期一般分为四个阶段,起始、延伸、终止、循环。在起始阶段,mRNA被真核启动因子(eIF)eIF4F复合物所识别,该复合物含有eIF4E、eIF4G和eIF4A。该复合物结合修饰的核苷酸帽在mRNA的5’端,导致mRNA激活翻译。一系列分子间识别事件导致43S复合物被招募到这个激活的mRNA中;43S复合物包含小(40S)核糖体亚基、eIFS(eIF3、eIF1、eIF1A和eIF5)和eIF2-Met-tRNAiMet-GTP三元复合物。其次,在ATP水解依赖过程中,核糖体亚基和相关因子在5‘至3’方向扫描mRNA序列。在扫描过程中,eIF2结合的GTP被水解(由eIF5刺激)。这种扫描的目的是找到合适的起始密码子,最常用的是AUG。当选择一个起始密码子时,在P位点与Met-tRNAiMet形成密码子-反密码子相互作用,形成48S前引发复合物。磷酸盐通过eIF2和构象变化释放,涉及许多eIF(eIF2、eIF1A、eIF1和eIF5B)和eIF5B上的第二个GTP水解事件,导致大多数蛋白质因子的释放和大(60S)核糖体亚基的连接,形成一个具有延伸能力的80S核糖体。在延伸过程中,密码子由真核伸长因子(EF)EF1A在GTP水解依赖过程中传递的氨基酰化tRNA读取。当t RNA解码信息并进入核糖体时,它们将同源氨基酸传递到生长的多肽链上。每个肽键的形成随后是GTP水解依赖的易位eEF2和下一个tRNA的传递。一旦形成肽链,核糖体必须终止蛋白质合成,释放蛋白质,并允许核糖体再次使用(回收)。一旦一个终止密码子(UAA、UGA或UAG)进入A位点,就会被真核释放因子(ERF)所识别。电子射频与其他因素的作用,包括ATP结合盒亚家族E成员1(ABCE1)、连接蛋白和潜在的其他因素,导致肽的释放、亚基解离、tRNA释放和核糖体循环。在循环过程中,下一轮翻译所需的蛋白质因子被加载回核糖体亚基;这些包括组成多因子复合物(MFC)的蛋白质[8]。
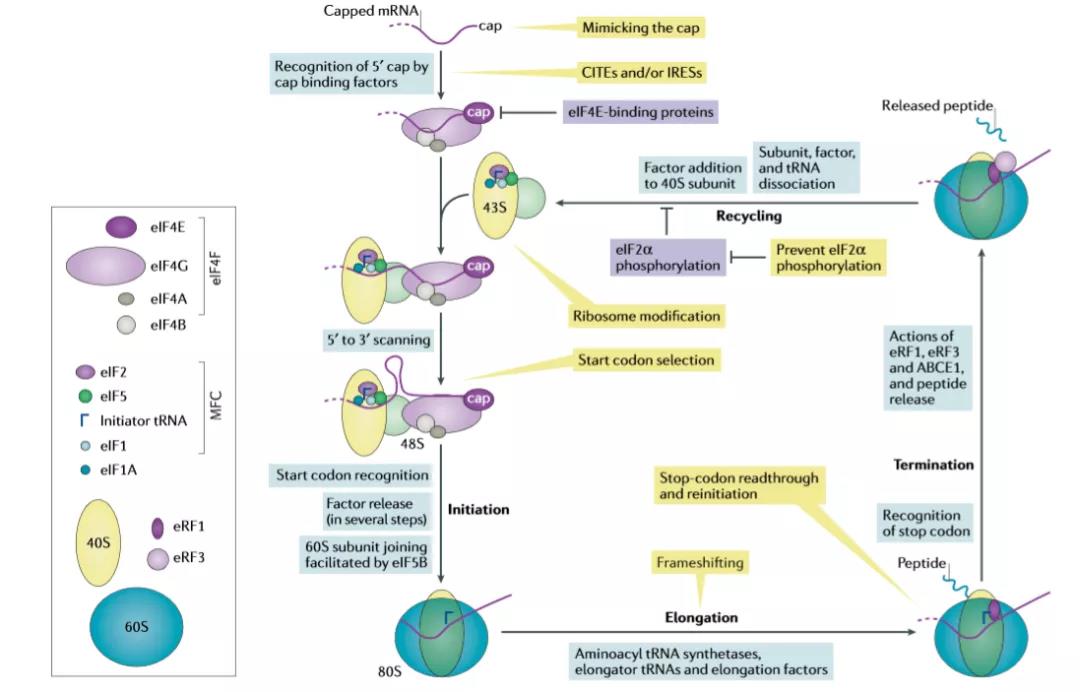
图2 宿主细胞翻译过程及病毒影响节点
病毒在许多步骤中与翻译过程相互作用并利用翻译过程,有两个特定阶段是值得注意的,第一个阶段主要是通过因子eIF4E的低磷酸化造成其失活或通过对eIF4E结合蛋白1和2(4E-BP1/2)的截留而影响mRNA的募集过程。第二个阶段是通过eIF2α亚基磷酸化抑制起始tRNA的传递。同时,特异性激酶对许多病毒感染引起的应激反应起作用,最常见的是通过病毒复制复合物感知双链RNA病毒复制中间体或由病毒复制复合体引起的内质网应激。因此,翻译调节相关蛋白成为新冠相关药物选择和开发中值得继续关注的靶点(见下表)。
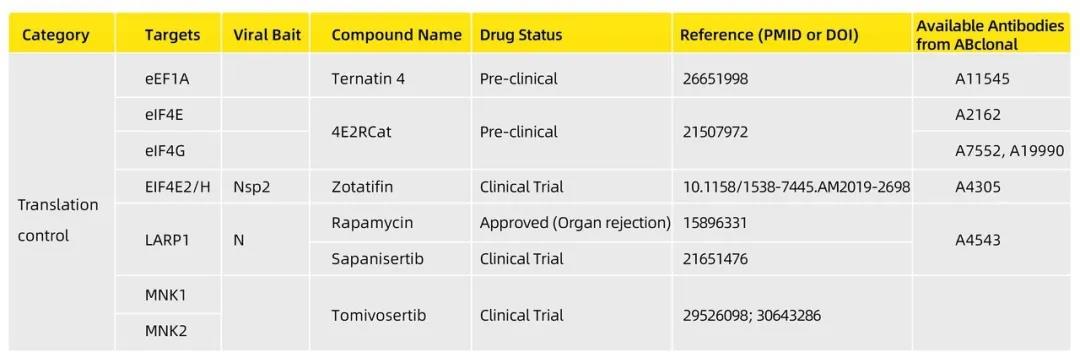
4、其他新发现的潜在药物靶点
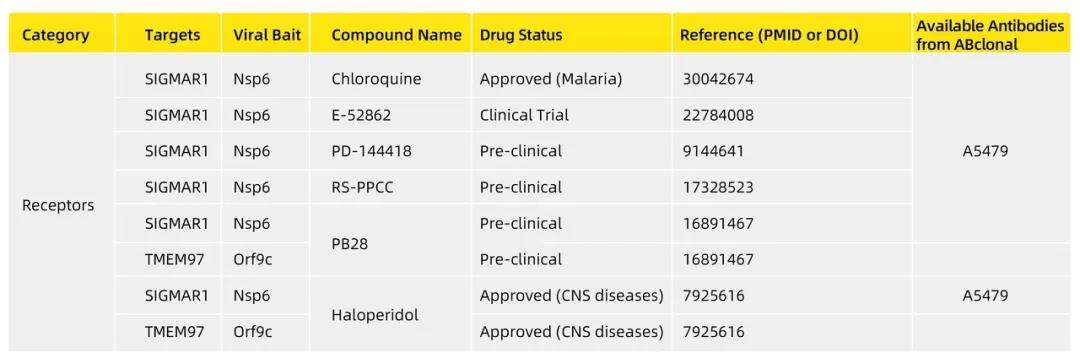
在这篇Nature文献当中,研究小组还确定了一组药物,其工作方式完全不同。研究小组发现了一些与SigmaR1和SigmaR2受体相互作用的药物或分子表现出抗病毒活性,其中包括两种抗精神病药物(氟哌啶醇和美培酮),两种有效的抗组胺药(克司汀和氯帕司汀),还包括化合物PB28和雌性激素孕酮(见下表)。目前,还不清楚病毒蛋白是如何操纵SigmaR1和SigmaR2受体的,研究人员推测病毒可能使用这些受体来帮助复制自己,因此降低它们的活性可能会抑制复制并减少感染。
综上所述,”老药新用”具有高效、低成本的特点,基于”老药新用”的新药开发显然在很大程度上缓解了新药开发的诸多问题。而且,近年来由于生物信息学、高通量筛选等技术的提高,”老药新用”的能力也得到了很大的提升,相信”老药新用”的策略在新冠相关药物开发及其他医药领域会发挥更大的作用。
>>>> 参考文献
1.Nature 2020 Apr 30. doi: 10.1038/s41586-020-2286-9.
2.Proc Natl Acad Sci U S A. 2020 May 26;117(21):11727-11734.
3.Cell. 2020 Apr 16;181(2):271-280.e8. doi: 10.1016/j.cell.2020.02.052.
4.Cell Mol Immunol. 2020 Apr 7:1-3. doi: 10.1038/s41423-020-0424-9.
5.Stem Cell Rev Rep. 2020 Apr 20:1-7. doi: 10.1007/s12015-020-09976-7.
6.Nat Commun . 2020 Mar 27;11(1):1620. doi: 10.1038/s41467-020-15562-9.
7.Cell. 2020 May 14;181(4):914-921.e10. doi: 10.1016/j.cell.2020.04.011.
8.Nat Rev Microbiol. 2019; 17(2): 110–123.

