凋亡特点
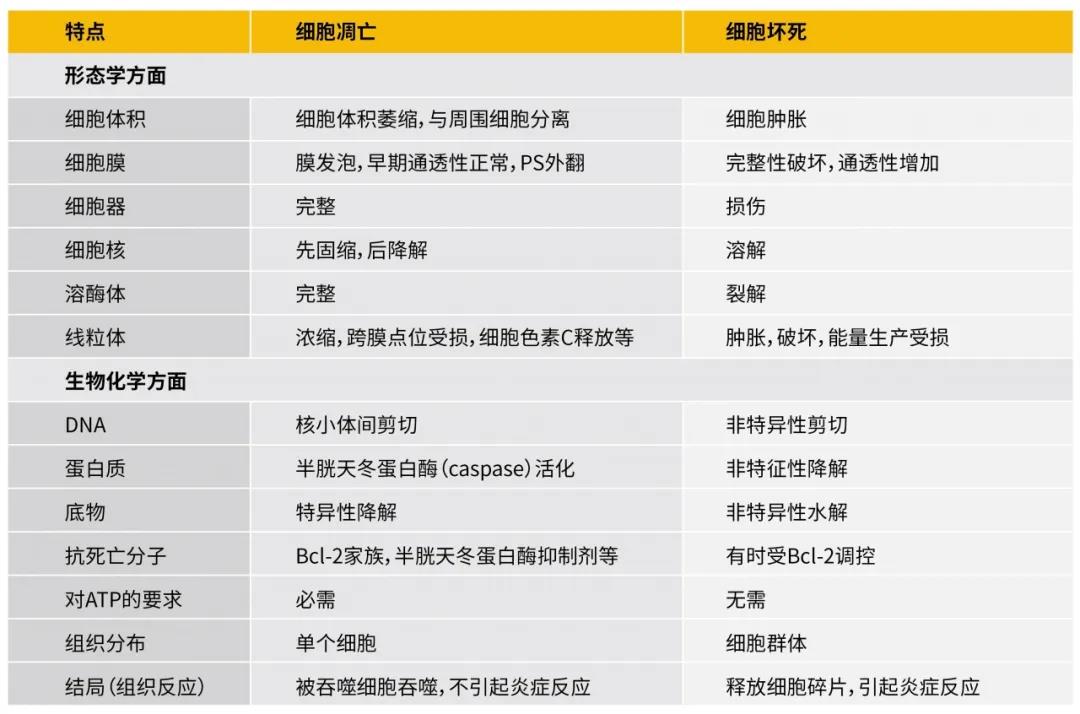
图1:细胞凋亡与细胞坏死比较
凋亡通路概述
细胞凋亡是一个异常复杂的级联调控过程,有两个主要的凋亡途径:外源性途径(死亡受体途径)和内源性途径(线粒体途径)。两种途径相互联系、共同调节而最终完成细胞凋亡[5,6]。外源性途径由细胞表面的死亡受体如Fas和肿瘤坏死因子受体家族(tumour necrosis factor receptor,TNF-R)引发[7]。参与的配体和相应的死亡受体包括FasL / FasR,TNF-α/ TNFR1,Apo3L / DR3,Apo2L / DR4和Apo2L / DR5 [8-11]。接头蛋白(FADD / TRADD)招募Pro-Caspase-8,导致死亡诱导信号复合体(DISC)的形成,Caspase-8 寡聚化并通过自催化被激活,激活的Caspase-8 进而诱导细胞凋亡[12]。内源性途径由细胞内信号介导,胞内信号响应于不同的应激条件(例如辐射、化疗等)在线粒体水平汇聚[13]。内部刺激如不可修复的遗传损伤、缺氧、胞浆Ca2+浓度极高以及严重的氧化应激,都是内在线粒体途径启动的触发因素[14]。随后激活的Bcl-2家族促凋亡成员-仅含BH3结构域蛋白(例如Bax、Bak)中和抗凋亡蛋白(例如Bcl-2、Bcl-xL和Mcl-1),使得线粒体外膜通透化(MOMP),导致细胞色素C 释放[15]。细胞色素C结合并激活Apaf-1和pro-Caspase-9,形成“凋亡小体” [16]。该过程依次激活下游效应蛋白Caspases-3,Caspases-6和Caspases-7,降解相应底物导致细胞凋亡[17,18]。信号通路图如下(图2):
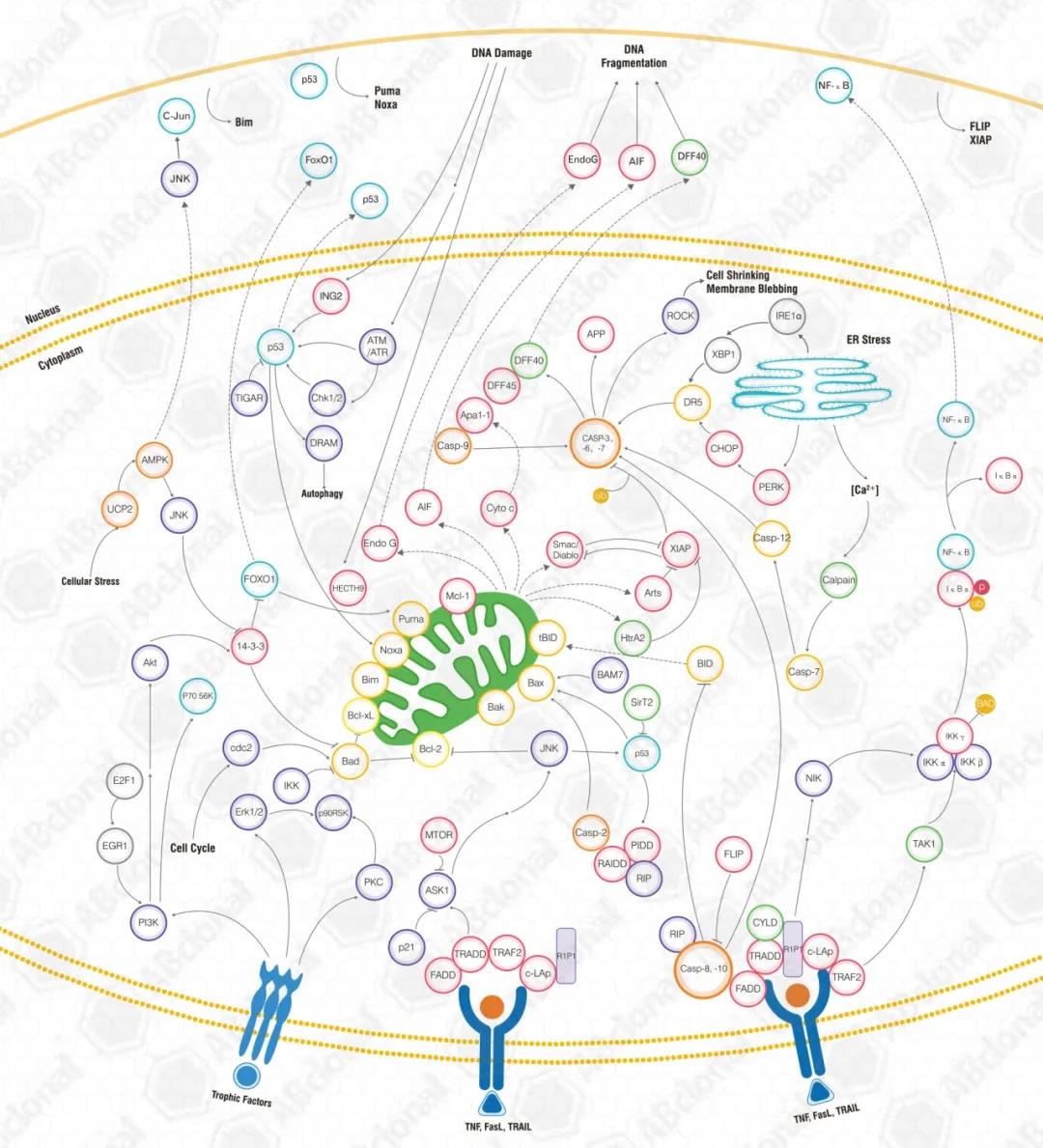
图2:凋亡信号通路
细胞凋亡检测解决方案
➤ 1、细胞凋亡过程中,经常会用到一些KO细胞模型,ABclonal为了方便大家进行机制研究,提供凋亡核心靶点KO细胞模型产品(图4),同时ABclonal也可提供CRISPR/Cas9基因敲除服务。
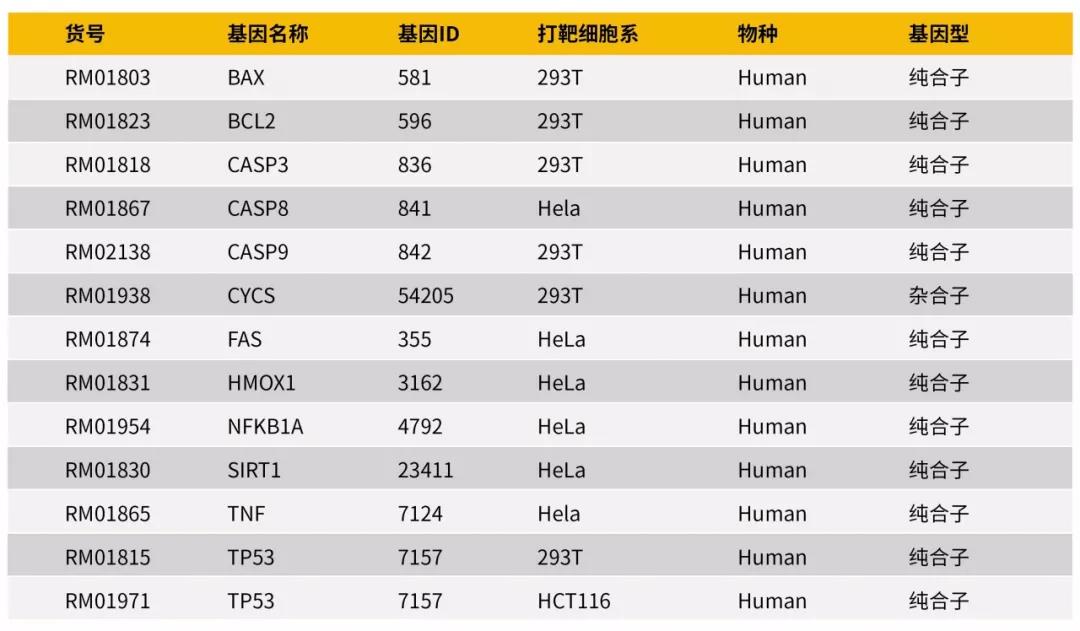
图3:凋亡核心靶点KO细胞模型(节选)
➤ 2、细胞凋亡常见检测方法
细胞凋亡与其他细胞死亡是完全不同的死亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以区别开来。
细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。
方法一:mRNA水平的检测
科学家们发现了很多在细胞凋亡时表达异常的基因,检测这些特异基因的表达水平也成为检测细胞凋亡的一种常用方法。据报道,Fas 蛋白结合受体后能诱导癌细胞中的细胞毒性T细胞(Cytotoxic T cells)等靶细胞。Bcl-2 和Bcl-xL作为抗凋亡的调节物,它们的表达水平比例决定了细胞是凋亡还是存活。因而可以用qPCR技术(➤详情请点击往期推文:新款通用型qPCR mix,专治各种不服 & 新品上市–Genious 2X SYBR Green Fast qPCR Mix & 新品发布:ABScriptⅡ One Step RT-qPCR Probe Kit)来检测Fas, Bax 和 Bcl-xL基因的 mRNA表达水平来进行细胞凋亡的检测。
方法二: 凋亡核心分子检测
通常以Western Blot检测凋亡通路明星蛋白,如Caspase家族蛋白Caspase-8、Caspase-6和Caspase-3的前体和剪接体,以及Caspase -3的底物PARP分子;又如Bcl-2家族蛋白,抑制凋亡的Bcl-2和促进凋亡的Bax,在以Western Blot检测Bcl-2和Bax的表达量后,通过Bcl-2/Bax的比值,可表征细胞凋亡的程度;细胞色素C(Cytochrome C)作为一种信号物质,正常情况下,它存在于线粒体内膜和外膜之间的腔中,凋亡信号刺激使其从线粒体释放至细胞浆,结合Apaf-1(Apoptotic protease activating factor-1)后启动Caspase级联反应,因而可以通过组化或荧光方法检测Cytochrome C定位来判断细胞凋亡。
案例展示
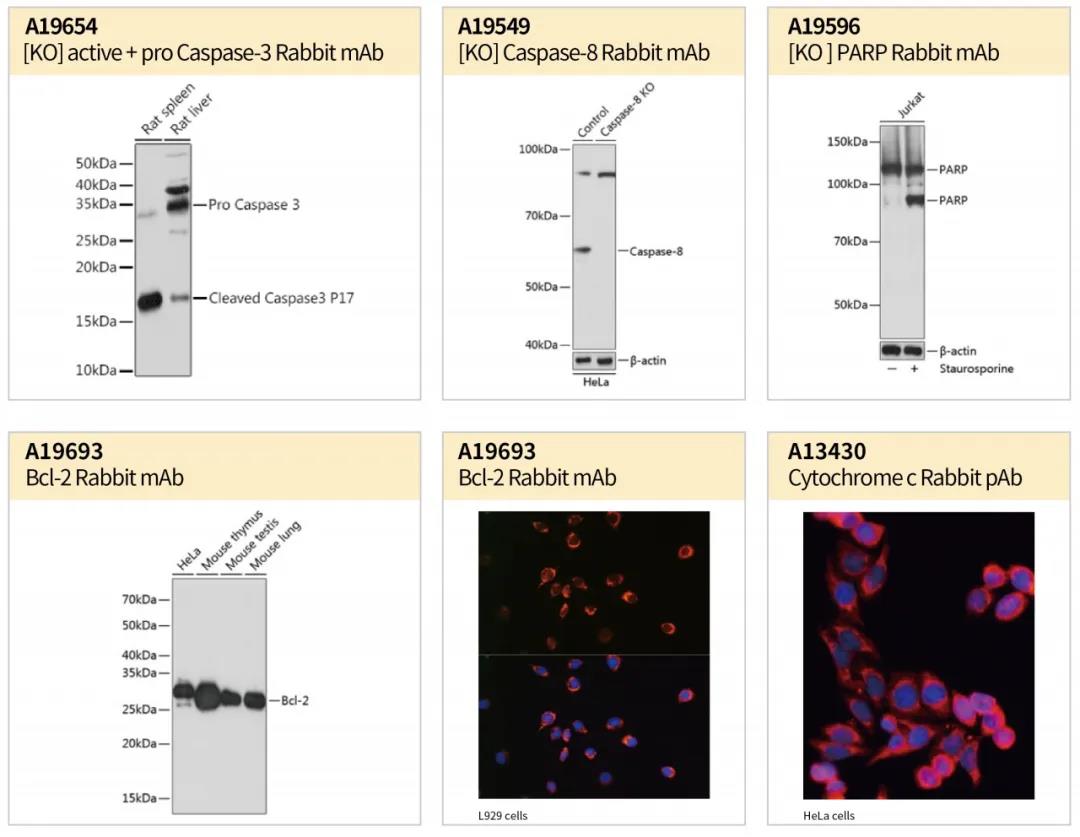
图4:案例展示
其他凋亡检测方法
方法三:流式细胞术检测(FCM, Annexin V-PI双染色实验)
在正常细胞中,磷脂酰丝氨酸(PS)只分布于细胞膜磷脂双分子层内侧,细胞处于凋亡早期时,PS发生外翻出现在细胞外侧,Annexin V作为一种磷脂结合蛋白,可与PS高度亲和,因而Annexin V是检测细胞早期凋亡的灵敏指标。PI是一种核酸染料,它不能透过完整的细胞膜,但在凋亡晚期和死细胞中,PI可透过细胞膜与细胞核结合。Annexin V和PI配合使用,可以将凋亡早期细胞和晚期细胞以及死细胞区分开来。需要注意的是随着研究的发展,Annexin V-PI双染色实验已经不能完全作为凋亡的一个独立判定标准,可先作为凋亡初期预测,需要配合其他检测方法一起判定是否不可逆的发生了细胞凋亡。
Annexin V-PI双染实验可将细胞分为四种类型(图5)
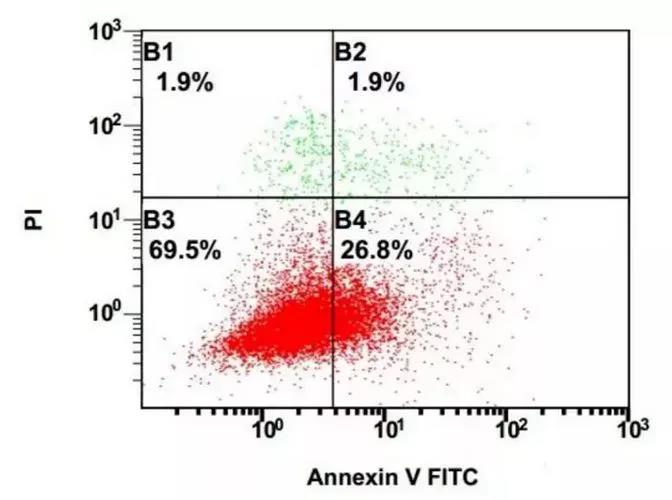
图5:Annexin V-PI双染色实验
B4象限:Annexin V阳性且PI阴性,为早期凋亡细胞;
B3象限:Annexin V阴性且PI阴性(双阴性细胞),为活细胞;
B2象限:Annexin V阳性且PI阳性(双阳性细胞),为晚期凋亡细胞;
B1象限:Annexin V阴性且PI阳性,为坏死细胞。
方法四:核酸电泳检测(DNA片段检测法)
细胞凋亡时DNA会发生片段化,形成200bp的整数倍;而细胞坏死时DNA发生无规则断裂。因而在凝胶电泳中,如果出现这种显著特征的电泳条带,就可以判断细胞发生了凋亡(图6)。
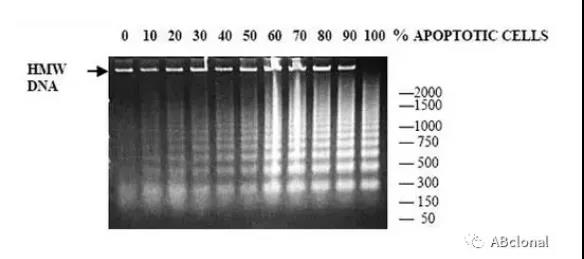
图6:DNA片段凝胶电泳
方法五:TUNEL分析凋亡相关DNA损伤
细胞凋亡中, 染色体DNA双链断裂或单链断裂而产生大量的粘性3′-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3′-末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal -deoxynucleotidyl transferase mediated nick end labeling, TUNEL)。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3′-OH形成,很少能够被染色。TUNEL实际上是分子生物学与形态学相结合的研究方法,对完整的单个凋亡细胞核或凋亡小体进行原位染色,能准确地反应细胞凋亡典型的生物化学和形态特征,可用于石蜡包埋组织切片、冰冻组织切片、培养的细胞和从组织中分离的细胞形态测定,并可检测出极少量的凋亡细胞,因而在细胞凋亡的研究中被广泛采用。
常见凋亡抑制剂和激活剂
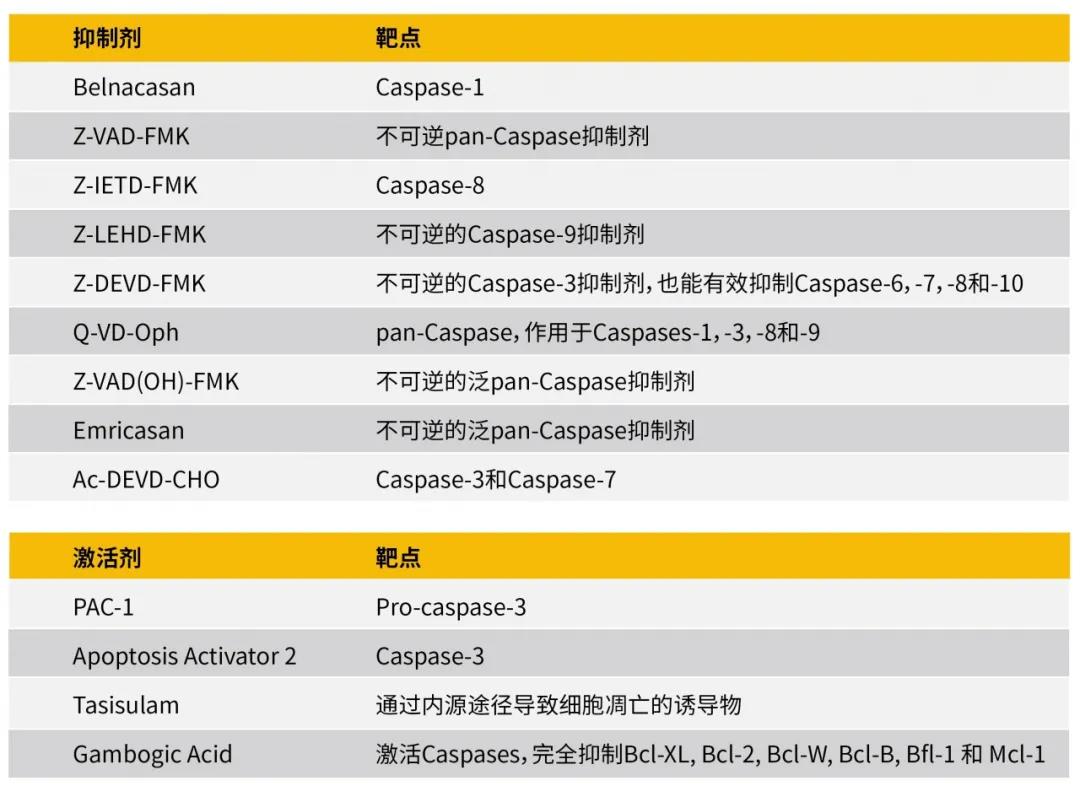
图7:常见凋亡抑制剂和激活剂
参考文献
1.Fuchs Y, Steller H. Programmed cell death in animal development and disease. Cell. 2011; 147; 742–758.
2.Hacker G. The morphology of apoptosis. Cell Tissue Res. 2000;301:5‐17.
3.Saraste A, Pulkki K. Morphologic and biochemical hallmarks of apoptosis. Cardiovasc Res. 2000; 45:528‐537.
4.Hengartner MO. Apoptosis: corralling the corpses. Cell. 2000; 104:325‐328.
5.Wong RSY. Apoptosis in cancer: from pathogenesis to treatment. JECCR. 2011; 30:87.
6.Igney FH, Krammer PH. Death and anti-death: tumour resistance to apoptosis. Nat Rev Cancer 2002;2:277–88.
7.Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science 1998;281:1305–8.
8.Chicheportiche Y, Bourdon PR, Xu H, Hsu YM, Scott H, Hession C, Garcia I, Browning JL. TWEAK, a new secreted ligand in the tumor necrosis factor family that weakly induces apoptosis. J Biol Chem 1997;272:32401–10.
9.Peter ME, Krammer PH. Mechanisms of CD95 (APO-1/Fas)- mediated apoptosis. Curr Opin Immunol 1998;10:545–51.
10.Suliman A, Lam A, Datta R, Srivastava RK. Intracellular mechanisms of TRAIL: apoptosis through mitochondrial-dependent and -independent pathways. Oncogene 2001;20:2122–33.
11.Rubio-Moscardo F, Blesa D, Mestre C, Siebert R, Balasas T, Benito A, Rosenwald A, Climent J, Martinez JI, Schilhabel M, Karran EL, Gesk S, Esteller M, deLeeuw R, Staudt LM, Fernandez-Luna JL, Pinkel D, Dyer MJ, Martinez-Climent JA. Characterization of 8p21.3 chromosomal deletions in Bcell lymphoma: TRAIL-R1 and TRAIL-R2 as candidate dosage-dependent tumor suppressor genes. Blood 2005;106:3214–22.
12.Boatright KM, Salvesen GS. Mechanisms of caspase ctivation. Curr Opin Cell Biol. 2003; 6:725‐731.
13.Green DR, Kroemer G. The pathophysiology of mitochondrial cell death. Science 2004; 305:626‐629.
14.Kroemer G, Galluzzi L, Brenner C: Mitochondrial membrane permeabilisation in cell death. Physiol Rev. 2007; 87:99‐163.
15.Danial NN, Korsmeyer SJ. Cell death: critical control points. Cell. 2004; 116:205‐219.
16.Hill MM, Adrain C, Duriez PJ, Creagh EM, Martin SJ. Analysis of the composition, assembly kinetics and activity of native Apaf-1 apoptosomes. Embo J 2004;23:2134–45.
17.Slee EA, Adrain C, Martin SJ. Serial killers: ordering caspase activation events in apoptosis. Cell Death Diff. 1999; 6:1067‐1074.
18.Kuribayashi K, Mayes PA, El‐Dery WS. What are caspases 3 and 7 doing upstream of the mitochondria. Cancer Biol Ther. 2006; 5:763‐765.

