基本信息
题目:Active RNA interference in mitochondria
期刊:Cell Research
影响因子:20.507
客户单位:中国科学院生物物理研究所和加州大学圣地亚哥分校
文章作者:博士研究生高宽兴和程满
通讯作者:张晓荣研究员和付向东教授
ABclonal引用产品:List of cited antibodies
| 靶点 | 品牌 | 货号 |
|---|---|---|
| NDUFV2 | ABclonal | A7442 |
| SDHA | ABclonal | A2594 |
| CYBB | ABclonal | A1636 |
| UQCRFS1 | ABclonal | A6784 |
| ATP5B | ABclonal | A5769 |
| NDUFA13 | ABclonal | A5412 |
| β-actin | ABclonal | AC026 |
| H3 | ABclonal | A2348 |
| COX5A | ABclonal | A6437 |
| COX5B | ABclonal | A2640 |
| MRPL44 | ABclonal | A4949 |
| ERP44 | ABclonal | A4526 |
| CytB | ABclonal | A9762 |
| ATP6 | ABclonal | A8193 |
导读
近年来,随着细胞生物学和分子生物学的发展,及对线粒体功能认识的逐渐深入,发现很多由线粒体功能损伤引起的疾病诸如耳聋,遗传性视神经病变LHON,NARP综合症,Leigh氏综合征,MELAS综合症,MERRF综合症,心肌症等,很多都是源于线粒体基因的突变(Tuppen et al., 2010, BBA)。对于这些由线粒体DNA突变所导致疾病治疗的需求使得对线粒体DNA(mtDNA)的研究处于基础科学、药物开发、临床治疗探索的中心。因此,如何有效编辑mtDNA以及调控线粒体基因表达便成了亟待解决的科学问题。
目前基因组编辑技术主要有ZFN,TELEN以及CRISPR系统。由于很难将sgRNA跨越线粒体双层膜转运到线粒体基质中,目前应用最为广泛的CRISPR系统在线粒体中很难实现基因编辑。另一方面,为了克服sgRNA转运问题而开发出来的线粒体靶向的TALEN核酶(mitoTALENs)以及线粒体靶向的锌指核酶(mtZFNs)系统利用依赖于蛋白重复结构域识别碱基序列来编辑线粒体基因组(Gammage et al., 2018, Trend inGenetics)。包括最近哈佛大学刘如谦团队发展的基于mitoTALEN的线粒体DNA编辑手段在一定区域内可实现同一类型碱基替换 (Mok, 2020, Nature)。另外,每个细胞中线粒体的数目在数百到上万不等并处于融合与分裂的动态变化中,所以这种编辑很容易丢失且很难达到同质性(Homogenized)效果。
2014年张晓荣博士等研究人员发现miRNA以及其效应蛋白Argonaute2(Ago2)存在于线粒体中,并在肌肉分化过程中增强线粒体基因表达的作用,该文章证明miRNA能够进入线粒体;并通过胰酶保护试验证明了Ago2存在于线粒体基质(Zhang et al., 2014, Cell)。该研究工作揭示了miRNA调控的新机制,为线粒体基因表达调控增添了新的层级。
2020年8 月17 日,中科院生物物理所张晓荣团队和加州大学圣地亚哥付向东教授在Cell Research上发表了题为Active RNA interference in mitochondria的研究论文,该研究利用mitoRNAi技术研究了线粒体呼吸链复合体之间的调控,并且,mitoRNAi将为源于线粒体DNA突变的疾病治疗提供一种潜在的解决方案。

RNA干扰(RNA interference, RNAi)现象在本世纪初首次在线虫中发现(Fire et al., 1998, Nature)。随后发现在酵母、锥虫、果蝇、植物以及哺乳动物中都有存在,到目前为止其作用机制已经非常明了,且应用广泛。但这些应用主要集中于细胞质以及细胞核中,而对于半自主性细胞器(如线粒体)中是否存在类似的RNA干扰机制则仍未可知。基于siRNA与miRNA具有相似的大小,且通过相似的机制并由Ago2蛋白介导起作用,研究者推测siRNA在线粒体可能也会发挥调控作用。
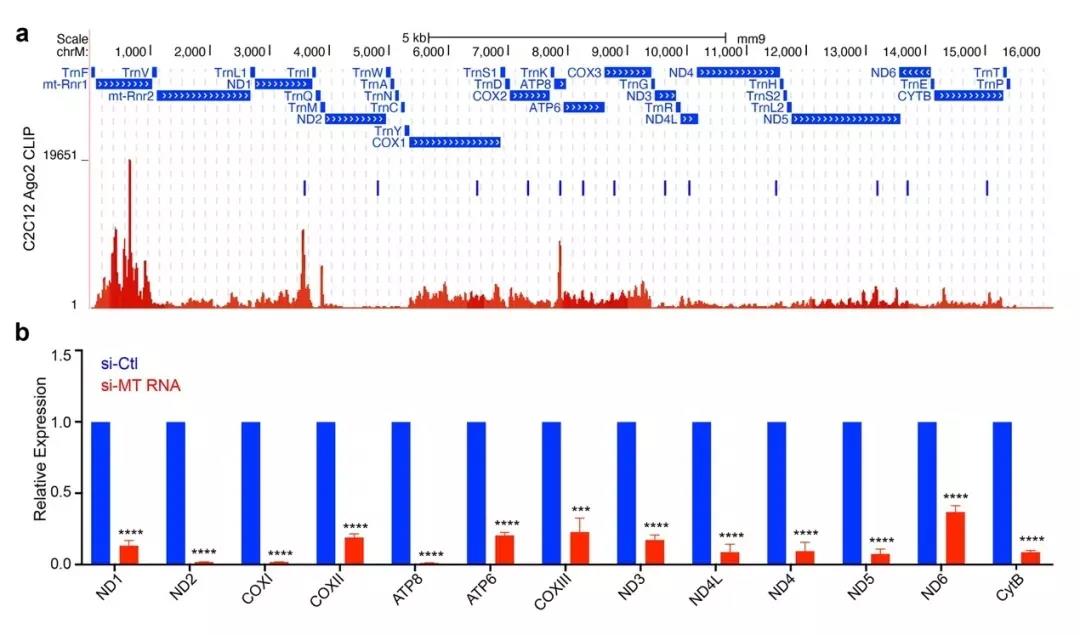
图1. mitoRNAi应用于敲低线粒体基因:a. 依据Ago2 结合位点设计的siRNA在线粒体基因上的位置分布;b. 在C2C12细胞中,RT-qPCR检测siRNA敲低13个线粒体编码亚基后的mRNA水平。
基于这些证据,论文作者的研究工作发展出了可以在线粒体中特异性的敲降线粒体编码基因的策略(命名为“mitoRNAi”)。并通过核酶保护试验、免疫荧光共定位实验、ClickIn实验(Logan et al., 2016, Cell Metabolism)证明了siRNA可以进入到线粒体基质中,但是其通过什么通道进入线粒体中仍然有待进一步探索。
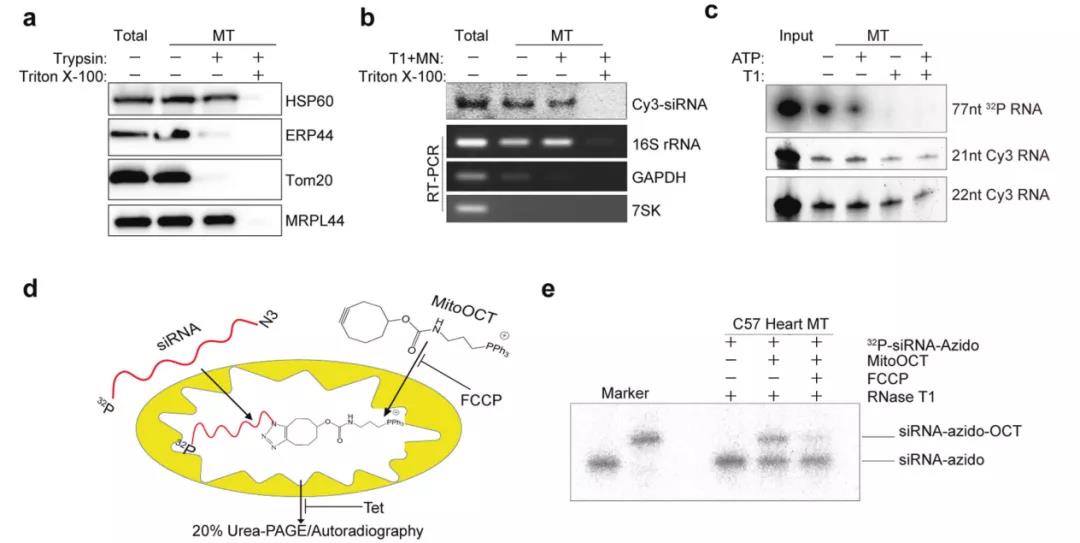
图2. 通过核酸酶保护,体外RNA导入和ClickIn分析检测线粒体中的小RNA。
基于Ago2 CLIP数据优化了siRNA的设计并通过qPCR与northern blot验证了mitoRNAi的敲降效果,并通过线粒体DNA缺失细胞排除了细胞核中线粒体假基因的影响。接着研究者从线粒体编码蛋白亚基的稳定性差异角度,来阐述了对不同复合体亚基蛋白敲低的策略,且通过新生蛋白水平的变化对敲降做了进一步的验证。最后,研究者通过mitoRNAi发现敲降线粒体编码亚基后对线粒体功能产生了重大的影响。
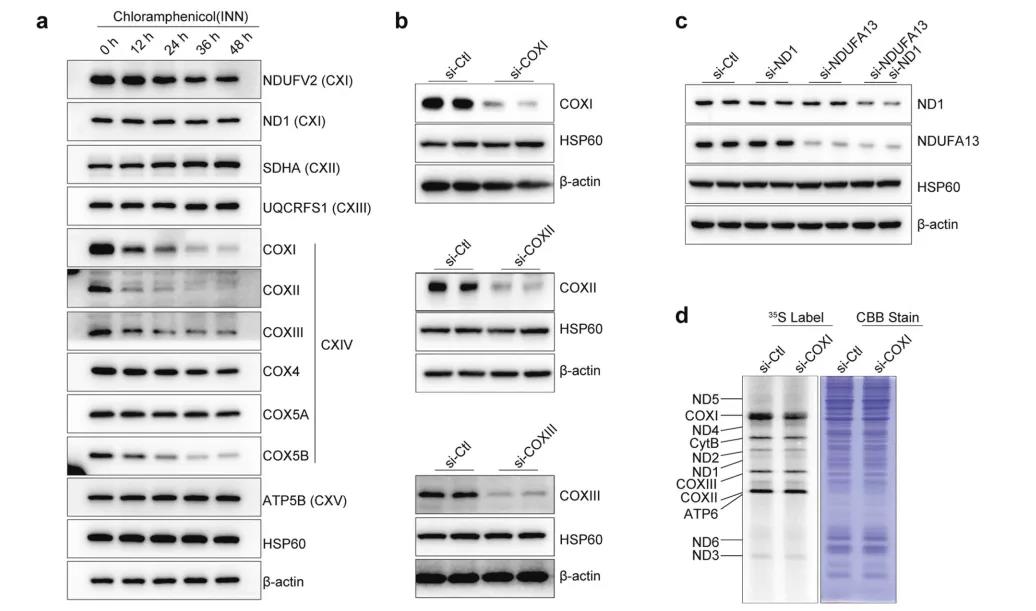
图3.蛋白质稳定性和siRNA靶向效率分析。a. MEF细胞经氯霉素(INN)处理不同时段后,采用WB分析细胞中代表性的nDNA和mtDNA编码的线粒体蛋白。HSP60和β-actin作为上样内参。b. WB分析对照样本和特定siRNA处理样本中的COXI,COXII或COXIII蛋白。C. WB分析siRNA处理后的ND1蛋白。d. COXI siRNA或空白处理C2C12细胞48小时后,将线粒体翻译产物35S标记1小时。考马斯亮蓝染色(右图)。
截止目前为止,对线粒体基因功能的研究基本上都是通过突变细胞系来实现,而突变细胞系的会造成细胞产生适应性改变,而张晓荣团队发展的mitoRNAi可以排除这种适应性的改变,且可以将其扩展到线粒体基因功能的研究工作中。研究团队利用mitoRNAi技术研究了线粒体呼吸链复合体之间的调控,并为下一步研究工作提供了新的工具以及思路。更重要的是,mitoRNAi将为源于线粒体DNA突变的疾病治疗提供一种潜在的解决方案。
武汉大学与生物物理研究所联合培养博士生高宽兴与生物物理研究所博士生程满为共同第一作者,张晓荣研究员与加州大学圣地亚哥分校付向东教授为共同通讯作者。该研究得到自然科学基金委、科技部、中国科学院的经费资助。

