
上期推文中ABclonal邀请一作刘兴副研究员解读了中科院水生所肖武汉团队在EMBO Journal杂志上发表的题为“SIRT5 impairs aggregation and activation of the signaling adaptor MAVS through catalyzing lysine desuccinylation”的研究论文,首次揭示了琥珀酰化修饰以及SIRT5介导的去琥珀酰化修饰在抗病毒先天免疫中的功能和机制。作者提出如下模型:先天免疫信号通路中的接头蛋白MAVS存在着琥珀酰化翻译后修饰,SIRT5可以与MAVS相互结合并介导MAVS的去琥珀酰化修饰,从而抑制MAVS多聚化的形成以及下游转录因子IRF3的磷酸化和二聚化,进而抑制干扰素等抗病毒相关基因的表达,从而在抗病毒先天免疫中发挥重要的生物学功能。
大家可能疑问什么是RIG-I-MAVS信号通路抗病毒天然免疫?本期将给大家聊聊这个。
天然免疫系统是机体抵御病原微生物入侵的第一道生理防线,对于限制病毒感染作用重大。其依靠若干组模式识别受体(PRRs,pattern recognition receptors)来识别病毒核酸。这些PRRs包括胞浆DNA感受器环鸟苷酸腺苷酸合成酶(cGAS)和胞质RNA感受器视黄酸诱导基因I(RIG-I),分别识别病毒DNA和病毒RNA。这些受体一旦被活化,将诱导cGAS-STING和RIG-I-MAVS信号通路传递抗病毒信号,最终诱导I型干扰素(IFN)以及促炎因子的表达,进而促进抗感染免疫应答,直到病毒被清除后,这些信号通路及时下调或关闭。下面我们来具体了解一下天然免疫系列RIG-I-MAVS信号通路及病毒RNA感染研究解决方案。
1、RIG-I-MAVS通路概述
作为首要的胞浆RNA监测机制,RIG-I-MAVS信号通路被作为一种抗病毒感染的天然免疫保护系统受到深入研究 [1]。RIG-I样受体(RLRs),包括RIG-I、MDA5和LGP2(图1),是检测病毒感染或复制过程中积累的多种病毒RNA的一系列胞浆RNA解旋酶 [2]。在除浆样树突状细胞(pDCs)以外的大多数细胞类型中,RLRs对于抗病毒反应是必不可少的。RIG-I和MDA5表现出不同的配体特异性,并对不同的病毒作出反应,而LGP2促进或拮抗MDA5和RIG-I对病毒RNA的识别 [3]。进一步的研究还发现了其他病毒感受器,如OAS1,它是干扰素诱导下可以被dsRNA激活的抗病毒分子酶,在细胞天然抗病毒反应中起着至关重要的作用。这种蛋白质激活潜在的RNaseL,从而导致病毒RNA降解和抑制病毒复制 [4]。
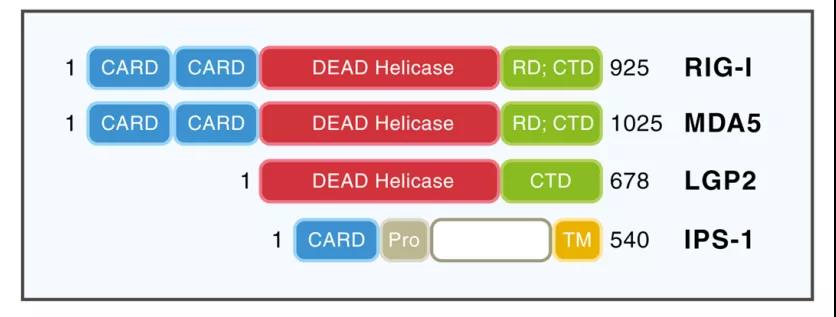
图1:RLRs 家族蛋白及其配体IPS-1/MAVS蛋白结构。RIG-I或MDA5的分子结构中包含N端两个串联的CARDs(CARDs,caspase activation and recruitment domains)结构域,中间一个DECH解旋酶结构域,C端抑制性结构域(RD,repressor domain)与C端CTD(CTD,C-terminal domain)结构域。图片来自Loo YM, Gale M Jr. Immunity. 2011.
静息状态下的RIG-I处于自身抑制状态,其CARDs结构域结合于解旋酶结构域的插入区;当RNA病毒入侵后,CTD结构域感应并结合5’三磷酸双链RNA,使得RIG-I分子转变为开放构象并释放CARDs结构域,释放的CARDs结构域会形成四聚体,并通过CARD-CARD相互作用招募位于线粒体外膜的MAVS(也被称为VISA, CARDIF和IPS-1)蛋白。MAVS作为RLR信号传递的核心接头蛋白,在控制下游信号传递中发挥作用。二聚化的MAVS直接招募TRAF2、TRAF3、TRAF5、TRAF6、CARD9和TRADD等分子,作为在线粒体外膜组装信号复合物的平台[5]。这些信号复合体包含由TRAFs或TRADD进一步招募的其他多种蛋白,包括CIAP1/2、TANK-NAP1-Tbkbp1、TAB2/3-TAB1-TAK1、TBK1-IKKε、IKKα-IKKβ-IKKγ、和RIP1-FADD-Casp8-Casp10 [6]。通过这些信号复合体,RIG-I-MAVS信号级联最终导致IRF3,IRF7,NF-κB和AP-1的磷酸化和激活,它们共同作用于诱导干扰素和促炎细胞因子的表达。与许多信号通路一样,RIG-I-MAVS信号通路也存在精密的调控方式来实现信号的平衡,包括信号蛋白的翻译后修饰(如泛素化、磷酸化修饰)调节或竞争性蛋白相互作用[7]。此外,RIG-I-MAVS信号通路还会与cGAS-STING[8]、炎症小体[9]和自噬[10,11]等多条信号通路发生串话,增加了RIG-I-MAVS信号调节和功能的复杂性。

图2:RIG-I-MAVS信号通路及其关键调控靶点。图片来自Furr SR, Marriott I. Front Microbiol. 2012.
2、抗病毒研究解决方案
>>>>1.干扰素和促炎细胞因子水平检测
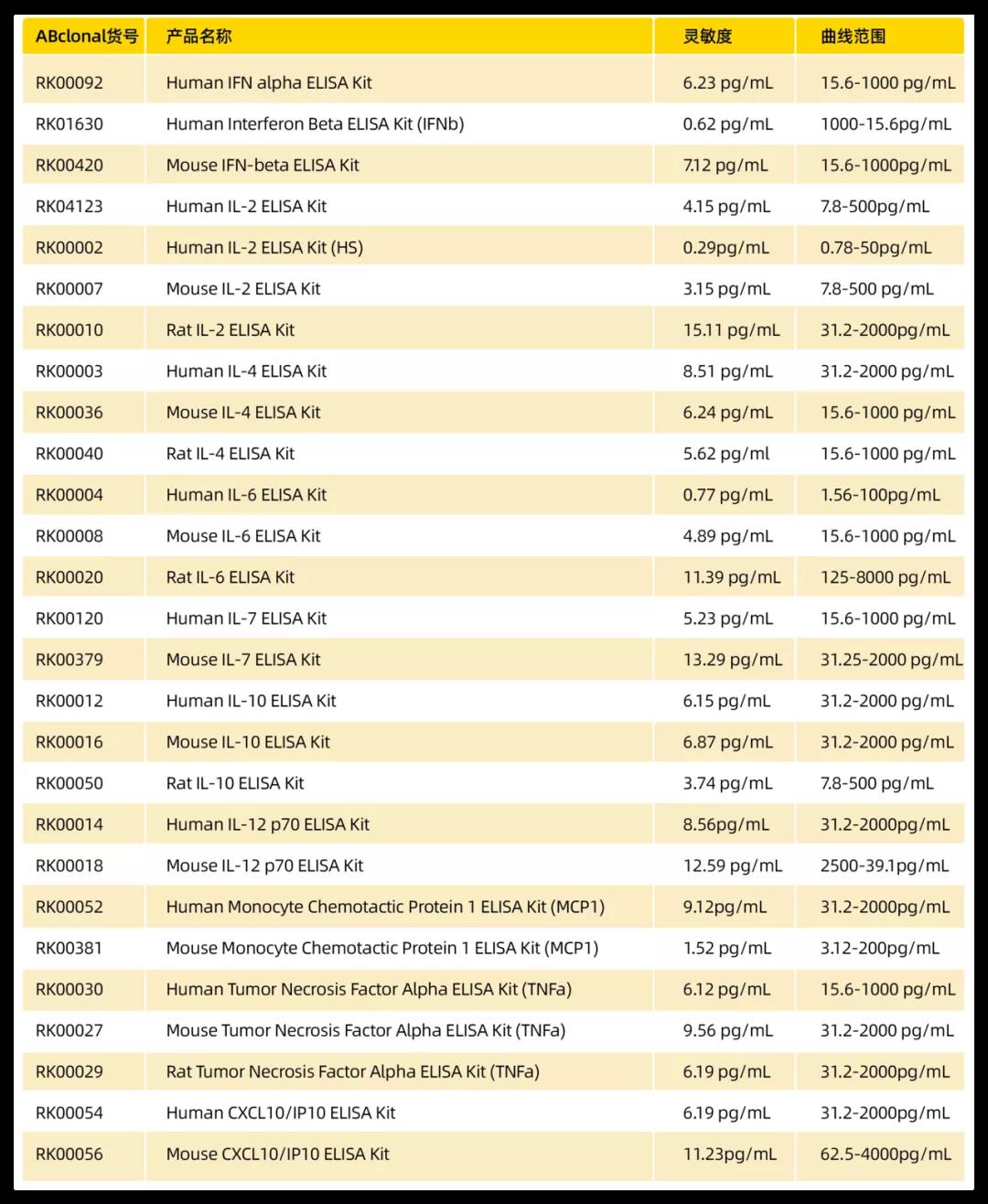
当病毒入侵后,胞内“吹哨者”RIG-I 或 MDA5 识别 dsRNA,通过下游 MAVS 蛋白传递抗病毒信号,最终诱导干扰素和促炎细胞因子的表达。所以可以通过直接测定干扰素和促炎细胞因子水平,判断是否发生抗病毒免疫。ABclonal提供相应ELISA试剂盒(图3)。
>>>>2.WB检测胞内“吹哨者”蛋白水平
病毒侵入机会后,病毒蛋白会让监控蛋白RIG-I 、MDA5、MAVS等失活或降解,躲避机体免疫机制。
RIG-I / DDX58 Rabbit pAb
A0550

Western blot analysis of extracts of various cell lines, using RIG-I / DDX58 antibody (A0550) at 1:500 dilution.
MAVS Rabbit pAb
A5764
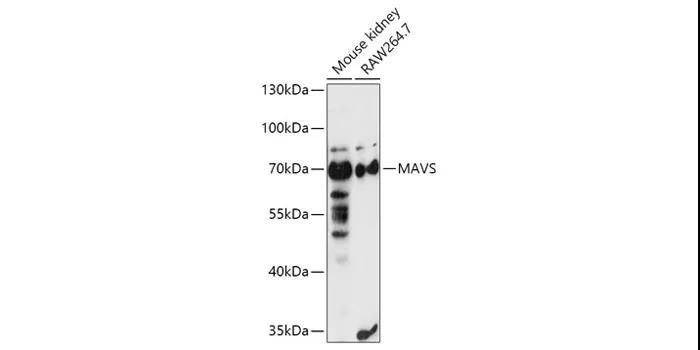
Western blot analysis of extracts of various cell lines, using MAVS antibody (A5764) at 1:1000 dilution.
>>>>3.免疫学检测RIG-I-MAVS 信号通路效应蛋白
机体感染病毒后,RIG-I-MAVS 信号通路持续活化,涉及一系列信号转导分子,转录因子及信号调节分子,与病毒蛋白展开拉锯战,直至病毒被彻底清除。ABclonal提供常见核心靶点研究工具。
[KO Validated] IRF3 Rabbit pAb
A11118
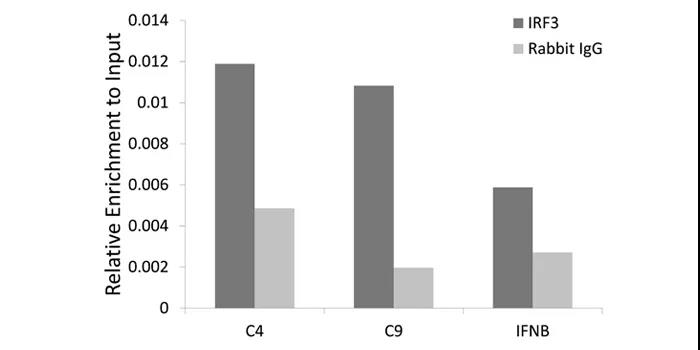
Chromatin immunoprecipitation analysis of extracts of HCT116 cell line, using IRF3 rabbit polyclonal antibody (A11118) and rabbit IgG. The amount of immunoprecipitated DNA was checked by quantitative PCR. Histogram was constructed by the ratios of the immunoprecipitated DNA to the input.
Phospho-NAK/TBK1-S172 Rabbit mAb
AP1026
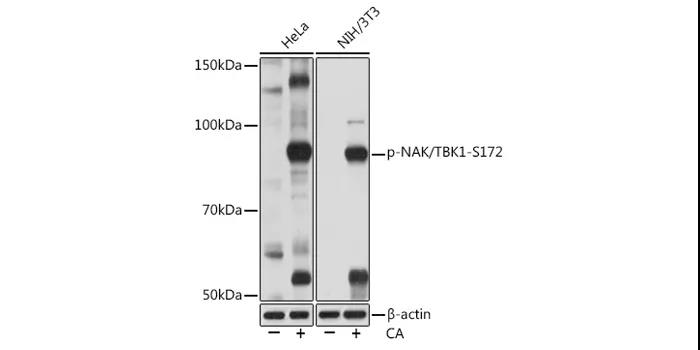
Western blot analysis of extracts of various cell lines, using Phospho-NAK/TBK1-S172 Rabbit mAb (AP1026) at 1:1000 dilution.
IKKε Rabbit pAb
A0244
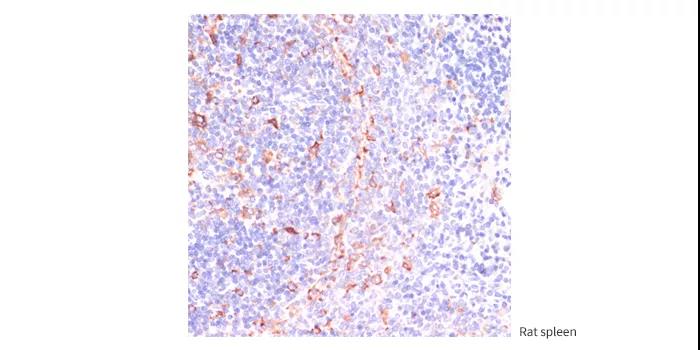
Immunohistochemistry of paraffin-embedded rat spleen using IKKε antibody (A0244) at dilution of 1:200 (40x lens).
参考文献
1.Front Immunol. (2014) 5: 342.
2.Curr Opin Virol. (2015) 12: 91-98.
3.Immunity. (2011) 34(5): 680–692.
4.Nucleic Acids Res. (2015) 43(10): 5236-5248.
5.J Mol Biol. (2013) 425(24):5009-5019.
6.J Mol Signal. (2013) 8: 7.
7.Eur J Immunol. (2017) 47(4):615-628.
8.Trends Immunol. (2017) 38(3): 194-205.
9.Curr Opin Virol. (2011) 1(3): 167-176.
10.Cell Discov.(2016) 2:16024.
11.Front Immunol. (2018) 9: 2096.

