聚焦
作为氧感应系统的核心分子,缺氧诱导因子(Hypoxia-inducible Factor, HIF) 能够感知细胞氧含量的变化并作出响应,在包括细胞增殖、细胞存活、细胞干性维持与分化、细胞死亡、细胞代谢、铁稳态与造血、血管发生、免疫炎症、细胞迁移与运动等多种细胞生物学过程中发挥独特调节作用。而肿瘤细胞由于快速增殖,常常会造成肿瘤局部细胞缺氧,进而使这些肿瘤细胞的代谢状态发生转变,其中研究最为深入的一种现象就是Warburg效应。那么,Warburg效应与氧感应系统有什么联系?又是如何联系在一起的呢?下面,让我们从Warburg效应的发现讲起。
1、Warburg效应的发现
20世纪20年代,Warburg和Cori进行的开创性研究发现癌细胞存在高糖消耗和大量乳酸释放[1,2],他们的研究激起了人们对癌细胞的能量产生过程与正常细胞存在何种差异进一步探索的兴趣。与主要依靠线粒体氧化磷酸化产生细胞过程所需能量的正常分化细胞相比,大多数癌细胞依赖于有氧糖酵解,其特点是葡萄糖转化为乳酸,即使在正常的氧水平下也是如此。并且,Warburg把这种现象产生的原因归结于癌细胞的线粒体功能异常[3,4]。因此,人们把癌细胞通过有氧糖酵解而不是线粒体氧化磷酸化产生能量的现象,称为Warburg效应,这一现象也被其他研究者在多种肿瘤类型中所证实[5-9](图1 A和B)。2000年,Hannahan和Weinberg发表了一份高度引用的综述文章,确定了六个癌症特征[10]。这些包括不受控制的增殖信号、对细胞凋亡的抗性、引发血管生成、获得复制的永生、活化侵袭和转移以及逃避生长抑制物。在过去的十年中,研究的不断进展增加了我们对癌症的认识,2011年,Hannahan和Weinberg延长了癌症特征的列表,以包括代谢重编程/去调节细胞能量学作为新兴的标志和潜在的癌症目标[11]。不受控制的增殖是癌症的重要特征之一,有人提出,能量代谢重编程对维持这种行为所需要的能量供应至关重要[11]。代谢重编程背后的确切原因尚不清楚,但可能的原因包括:(i)维持低氧条件下的高增殖速率[12];(ii)由于线粒体功能降低而逃避细胞凋亡[13]。

图1:Warburg效应和反向Warburg效应。A)在正常组织中,葡萄糖被生物转化为丙酮酸,并携带到线粒体中进行氧化磷酸化(OXPHOS);B)大多数类型的癌细胞倾向于发生糖酵解这种代谢方式,而不考虑氧的存在,这种代谢方式被称为有氧糖酵解或Warburg效应;C)一些癌相关成纤维细胞(CAFs)发生代谢重编程,进行有氧糖酵解,并分泌能量丰富的营养物质,以进入癌细胞线粒体并进一步氧化代谢,为癌细胞提供能量,这种现象被称为反向Warburg效应。(图片引用自Paolicchi E,et.al. (2016) Oncotarget. 7(12):13464-13478.)
2、Warburg效应的修正
但是值得注意的是,在过去的几十年里,技术的进步使得线粒体功能得到了更深入的研究,现在人们意识到部分癌细胞有活跃的和功能性的线粒体,即Warburg效应存在异质性[14,15]。在过去的十年里,研究表明不同的肿瘤细胞(实际上是肿瘤内的亚群)有不同的生物能量代谢改变。在肿瘤中,氧化代谢与糖酵解之间可能存在动态的相互转换,代谢的灵活性现在已经在一系列癌症被观察到[16-19]。除了与环境条件相关的代谢灵活性外,还有各种癌症相关基因突变的影响,其中许多基因突变对细胞代谢有影响。例如,线粒体三羧酸循环和呼吸链组分琥珀酸脱氢酶(SDH)的突变可引起嗜铬细胞瘤和副神经节瘤[20,21],异柠檬酸脱氢酶1(IDH1)的突变与成人胶质母细胞瘤的发生有关[22,23]。了解癌细胞环境和突变是如何影响代谢的,对于选择合适的代谢药物组合来影响患者的癌细胞生长至关重要。
同时,对肿瘤微环境的深入研究发现,肿瘤微环境中肿瘤细胞外的其他细胞也存在糖酵解现象,并由Pavlides等人首先在2009年提出了一个新的可能模型来理解Warburg效应在肿瘤代谢中的作用[24]。其假设是上皮癌细胞在邻近的间质成纤维细胞中诱导Warburg效应(有氧糖酵解)。这些肿瘤相关相关成纤维细胞,然后进行肌成纤维细胞分化,并分泌乳酸和丙酮酸(有氧糖酵解产生的能量代谢物)。乳酸通过单羧酸转运体4(MCT4)被输出到细胞外空间,最终通过MCT1被癌细胞吸收,并在线粒体三羧酸循环中使用它们,从而促进高效的能量生产(通过氧化磷酸化产生ATP),从而产生更高的增殖能力。在这种肿瘤发生的替代模型中,上皮癌细胞诱导正常的间质转化为具有伤口愈合特征的间质,为促进肿瘤生长和血管生成提供必要的能量丰富的微环境。我们把这个新模型称为“反向Warburg效应”[24]。这一替代模型仍然与Warburg最初的观察结果一致,即肿瘤显示代谢向有氧糖酵解转变。为了支持这一观点,Pavlides的研究小组对Cav-1缺陷的肿瘤相关成纤维细胞的蛋白质组学分析和转录谱分析表明,肌成纤维细胞标记物和多种糖酵解相关酶类在正常有氧条件下表达均有上调。Pavlides的研究小组后来还利用人乳腺癌细胞系(MCF-7和MDA-MB-231)与成纤维细胞共培养发现,成纤维细胞线粒体功能降低,乳腺癌细胞活性增强,证明了反向Warburg效应的存在(图1C)[25]。
同时,还需要注意,Warburg效应并不是所有癌症细胞的普遍特征,同样,反向Warburg效应在所有肿瘤中也不是普遍存在的。Yoshida等人在2015年指出,表达高水平MCT4的肿瘤并没有表现出反向Warburg效应[26]。癌症的微环境不断变化,即使在同一肿瘤块内,癌细胞的代谢表型也可能存在不同[27]。虽然在低氧核心的实体肿瘤中很难概括,但Warburg效应最主要的原因可能是氧气水平的降低,促使细胞充分利用所有可用的葡萄糖。周围较活跃的增殖细胞可能利用缺氧区分泌的乳酸进行氧化[28],导致缺氧和有氧细胞之间的共生关系。
3、癌基因和抑癌基因在肿瘤细胞代谢中的作用
在一些肿瘤细胞中,多种原因导致的AKT异常活化参与了一些癌症的发生[29],它通过增加葡萄糖摄入和糖酵解酶的水平,在癌细胞中单独诱导有氧糖酵解[30]。与AKT活化效应相一致,癌基因c-Myc通过转录诱导各种糖酵解酶和LDHA激活糖酵解[31,32]。AKT诱导糖酵解的另一个机制是己糖激酶-Ⅱ的磷酸化,从而促使其与线粒体外膜电压依赖性的阴离子通道相联系,并影响肿瘤细胞凋亡[33,34]。而p53通过诱导抑癌基因PTEN抑制AKT活性,阻止细胞生长,抑制糖酵解,促进肿瘤细胞凋亡。除此之外,p53诱导TIGAR表达来下调糖酵解通量[35],提高还原能力[36];通过调节电子运输链(ETC)中环氧合酶的正调节因子SCO2的表达来促进线粒体呼吸[37],可能阻止活性氧(ROS)的产生。与此相一致,p53基因敲除提高了活性氧水平[38]。因此,p53可以阻止ROS的积累和随后的DNA损伤。
4、氧感应系统在肿瘤细胞糖代谢中的作用
在肿瘤的发生和发展过程中,肿瘤细胞和基质细胞对营养物质和氧气的获取往往受到限制。大多数实体性肿瘤确实存在长期或短暂的缺氧区域,原因是血管异常和血液供应不足。氧感应系统主要以缺氧诱导因子(HIFs)的调节为核心,可以促进肿瘤细胞和基质细胞对周围环境的适应和选择,从而促进有利于肿瘤进展的变化。HIF转录因子家族包括HIF1、HIF2和HIF3。这些因子均含有氧敏感的HIF-α亚基(HIF1-α、HIF2-α或HIF3-α),与组成性表达的HIF 1-β亚基相结合[39]。HIF1-α和HIF2-α蛋白在HIF-α亚基中的研究较为深入。HIF-α亚基含有的脯氨酸残基(HIF1-α:P 402/P 564和HIF2-α:P 405/P 531)在氧存在下被含脯氨酸羟化酶结构域蛋白(PHDs)羟基化。脯氨酸残基的羟基化促进了与肿瘤抑制因子VHL的结合,导致HIF-α泛素化和降解[40,41]。另一个以氧依赖方式调节HIF-α的抑制因子是FIH1,FIH1驱动的HIF1-α的天冬酰胺羟基化(较小程度上是HIF2-α)阻碍了HIF1与其辅助因子、组蛋白乙酰化酶p300和CBP的相互作用,从而影响HIF1转录活性[42-44]。低氧肿瘤微环境(TME)在肿瘤和基质细胞中受到HIF驱动的转录反应,HIF通过上调葡萄糖转运蛋白(GLUT)、多种糖酵解酶和LDHA对应基因表达,还通过PDK 1介导的丙酮酸脱氢酶(PDH)失活来抑制丙酮酸进入三羧酸循环,抑制氧化磷酸化,将细胞代谢转变为糖酵解模式,增加葡萄糖消耗以及丙酮酸、乳酸和H+的生成[45]。
同时,HIF与其他癌基因或抑癌基因存在“串话”。p53敲除[46]和c-Myc过表达[31]还增加HIF-1活性。在肿瘤中,c-Myc在转录水平上调了核糖核酸蛋白的表达,并导致PKM2(一种肿瘤细胞中PKM mRNA的可变剪切导致的PKM亚型) 的优先表达[47]。与PKM1不同的是,活性较低的PKM2可以受到含磷酸化酪氨酸的蛋白质的抑制,造成糖酵解中间代谢产物的积累,并用于其他生物合成[48]。有趣的是,PKM基因的转录由HIF-1和PKM2但非PKM1激活,PKM2增强HIF-1α与其靶基因的结合[49],构成正反馈回路。活性较低的PKM2有助于降低丙酮酸盐的使用,从而对Akt介导的对线粒体代谢的调控作用进行补充[30]。
短暂间歇性用低氧处理正常细胞,增加了正常细胞对糖酵解的依赖[33]。在这种应激状态下,活性氧生成增加,激活HIF-1[50],然后将野生型p53与正常细胞相关联并稳定[51],诱导其凋亡[52]。因此,只有p53失活的细胞才会存活,这可以解释这些癌细胞的存活,而不是那些p53完整的细胞。此外,间歇性低氧处理还会引起抑癌基因PTEN的降解,从而提高AKT活性[53]。
实体瘤细胞实际上暴露于不同氧浓度的梯度,缺氧的细胞(包括肿瘤细胞及相关其他细胞类型)通过HIF提高MCT4的表达,把内部通过糖酵解产生的乳酸盐泵出,然后再通过MCT1转运进入氧供应充足的细胞进行氧化代谢。事实上,最低氧的肿瘤细胞在肿瘤治疗后复发[54]和转移[55]扮演重要角色,其持续的高糖酵解速率[56]和自噬性活动[57]使它们更具韧性和攻击性。同时,最近的研究表明,癌细胞和邻近的基质细胞在能量代谢存在合作而不是竞争。尽管结肠直肠癌细胞存在高水平的GLUT1和LDH5,这有利于葡萄糖向乳酸的转化,但肿瘤相关成纤维细胞GLUT1表达水平较低,同时表达LDH1,有利于相反的反应[58]。因此,每个肿瘤细胞所采用的能量供应策略,在肿瘤内通过营养的可用性和相邻细胞的代谢状态来精细地调节。
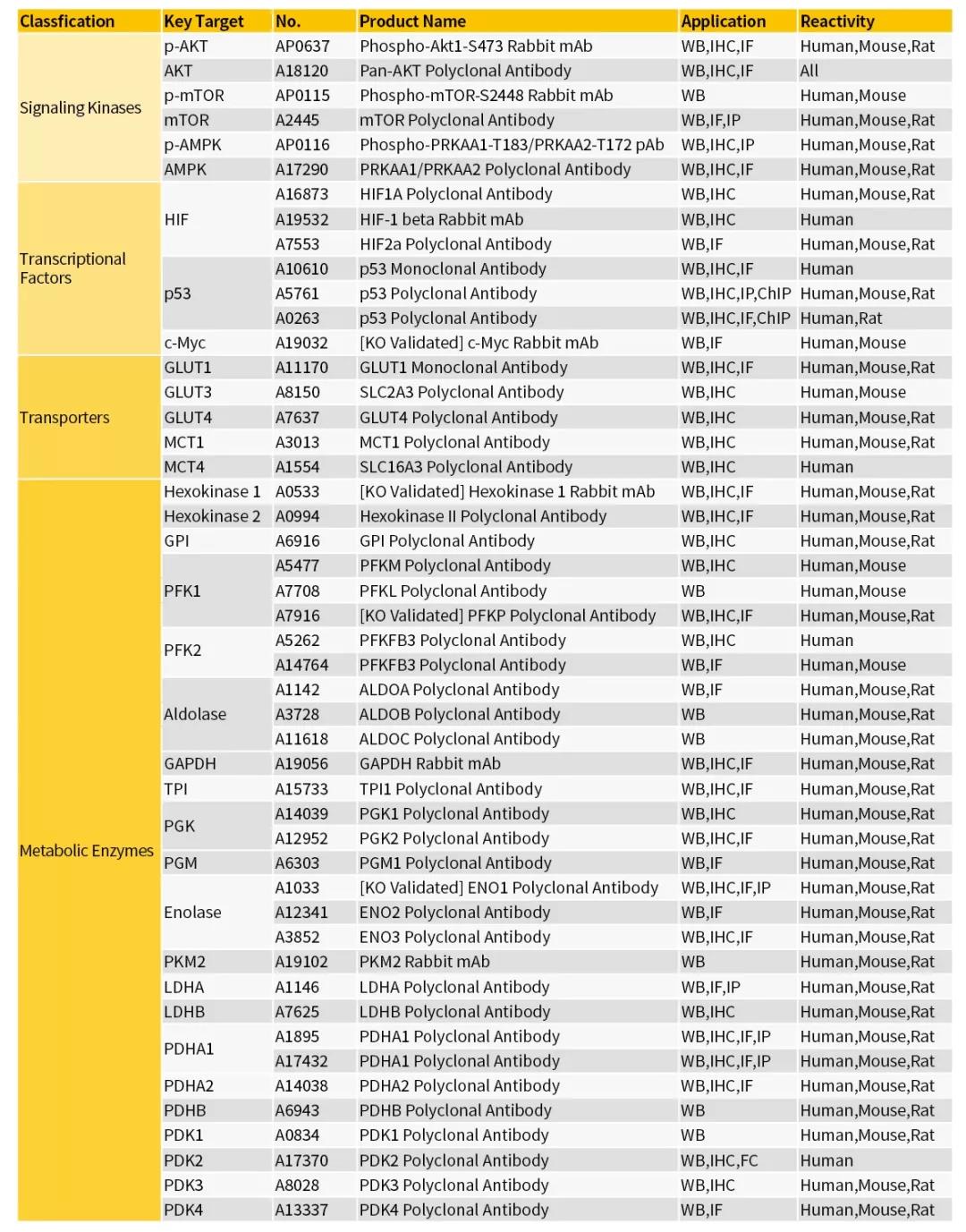
5、精选Warburg Effect研究产品
参考文献
1.Warburg O., Wind F. and Negelein E. (1927) The metabolism of tumors in the body. J. Gen. Physiol. 8, 519-530.
2.Cori C.A. and Cori G.T. (1925) The carbohydrate metabolism of tumours. J. Biol. Chem. 65, 397-405.
3.Warburg O. (1956) On the origin of cancer cells. Science 123, 309-314.
4.Warburg O. (1956) On respiratory impairment in cancer cells. Science 124, 269-270.
5.Sakashita M., et al. (2001) Glut1 expression in T1 and T2 stage colorectal carcinomas: its relationship to clinicopathological features. Eur. J. Cancer 37, 204-209.
6.Grover-McKay M., et al. (1998) Role for glucose transporter 1 protein in human breast cancer. Pathol. Oncol. Res. 4, 115-120.
7.Wu M., et al. (2007) Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. Am. J. Physiol. Cell Physiol. 292, C125-C136.
8.Lai J.-H., et al. (2013) Nodal regulates energy metabolism in glioma cells by inducing expression of hypoxia-inducible factor 1α. Neuro-Oncology 15, 1330-1341.
9.Michelakis E.D., et al. (2010) Metabolic modulation of glioblastoma with dichloroacetate. Sci. Transl. Med. 2, 31ra34.
10.Hanahan D. and Weinberg R.A. (2000) The hallmarks of cancer. Cell 100, 57-70.
11.Hanahan D. and Weinberg R.A. (2011) Hallmarks of cancer: the next generation. Cell 144, 646-674.
12.Gatenby R.A. and Gillies R.J. (2004) Why do cancers have high aerobic glycolysis? Nat. Rev. Cancer 4, 891-899.
13.Gogvadze V., Orrenius S. and Zhivotovsky B. (2008) Mitochondria in cancer cells: what is so special about them? Trends Cell Biol. 18, 165-173.
14.Ju Y.S., et al. (2014) Origins and functional consequences of somatic mitochondrial DNA mutations in human cancer. eLife 3, e02935.
15.Xu X.D., et al. (2015) Warburg effect or reverse Warburg effect? A review of cancer metabolism. Oncol. Res. Treat. 38, 117-122.
16.Jose C., Bellance N. and Rossignol R. (2011) Choosing between glycolysis and oxidative phosphorylation: a tumor’s dilemma? Biochim. Biophys. Acta, Bioenerg. 1807, 552-561.
17.Moreno-Sánchez R.,et al. (2007) Energy metabolism in tumor cells. FEBS J. 274, 1393-1418.
18.Martin M., et al. (1998) Energetic and morphological plasticity of C6 glioma cells grown on 3-D support; effect of transient glutamine deprivation. J. Bioenerg. Biomembr. 30, 565-578.
19.Obre E. and Rossignol R. (2015) Emerging concepts in bioenergetics and cancer research: metabolic flexibility, coupling, symbiosis, switch, oxidative tumors, metabolic remodeling, signaling and bioenergetic therapy. Int. J. Biochem. Cell Biol. 59, 167-181.
20.Astuti D., et al. (2001) Gene mutations in the succinate dehydrogenase subunit SDHB cause susceptibility to familial pheochromocytoma and to familial paraganglioma. Am. J. Hum. Genet. 69, 49-54.
21.Baysal B.E., et al. (2000) Mutations in SDHD, a mitochondrial complex II gene, in hereditary paraganglioma. Science 287, 848-851.
22.Dang L., et al. (2009) Cancer-associated IDH1 mutations produce 2-hydroxyglutarate. Nature 462, 739-744.
23.Yan H., Bigner D.D., Velculescu V. and Parsons D.W. (2009) Mutant metabolic enzymes are at the origin of gliomas. Cancer Res. 69, 9157-9159.
24.Pavlides S., et al. (2009) The reverse Warburg effect: aerobic glycolysis in cancer associated fibroblasts and the tumor stroma. Cell Cycle 8, 3984-4001.
25.Martinez-Outschoorn U.E., et al. (2011) Cancer cells metabolically ‘fertilize’ the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle 10, 2504-2520.
26.Yoshida G.J. (2015) Metabolic reprogramming: the emerging concept and associated therapeutic strategies. J. Exp. Clin. Cancer Res. 34, 111.
27.Lee M. and Yoon J.-H. (2015) Metabolic interplay between glycolysis and mitochondrial oxidation: the reverse Warburg effect and its therapeutic implication. World J. Biol. Chem. 6, 148-161.
28.Sonveaux P., et al. (2008) Targeting lactate-fueled respiration selectively kills hypoxic tumor cells in mice. J. Clin. Invest. 118, 3930-3942.
29.Staal SP. (1987). Molecular cloning of the akt oncogene and its human homologues AKT1 and AKT2: amplification of AKT1 in a primary human gastric adenocarcinoma. Proc Natl Acad Sci USA 84: 5034-5037.
30.Elstrom RL, et al. (2004). Akt stimulates aerobic glycolysis in cancer cells. Cancer Res 64: 3892-3899.
31.Shim H, et al.(1997). c-Myc transactivation of LDH-A: implications for tumor metabolism and growth. Proc Natl Acad Sci USA 94: 6658-6663.
32.Kim JW, et al. (2004). Evaluation of myc E-box phylogenetic footprints in glycolytic genes by chromatin immunoprecipitation assays. Mol Cell Biol 24: 5923-5936.
33.Kroemer G, Pouyssegur J. (2008). Tumor cell metabolism: cancer’s Achilles’ heel. Cancer Cell 13: 472-482.
34.Miyamoto S, Murphy AN, Brown JH. (2008). Akt mediates mitochondrial protection in cardiomyocytes through phosphorylation of mitochondrial hexokinase-II. Cell Death Differ 15: 521-529.
35.Yalcin A, et.al. (2009). Regulation of glucose metabolism by 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatases in cancer. Exp Mol Pathol 86: 174-179.
36.Bensaad K, et al. (2006). TIGAR, a p53-inducible regulator of glycolysis and apoptosis. Cell 126: 107-120.
37.Matoba S, et al. (2006). p53 regulates mitochondrial respiration. Science 312:1650-1653.
38.Lebedeva MA, Eaton JS, Shadel GS. (2009). Loss of p53 causes mitochondrial DNA depletion and altered mitochondrial reactive oxygen species homeostasis. Biochim Biophys Acta 1787: 328-334.
39.Wang, G. L., Jiang, B. H., Rue, E. A. & Semenza, G. L.(1995) Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated d by cellular O2 tension.Proc. Natl. Acad. Sci. USA 92, 5510-5514 .
40.Jaakkola, P. et al. (2001) Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 292, 468-472.
41.Ohh, M. et al. (2000) Ubiquitination of hypoxia-inducible factor requires direct binding to the beta-domain of the von Hippel-Lindau protein. Nat. Cell. Biol.2, 423-427.
42.Koivunen, P., Hirsila, M., Gunzler, V., Kivirikko, K. I. & Myllyharju, J. (2004) Catalytic properties of the asparaginyl hydroxylase (FIH) in the oxygen sensing pathway are distinct from those of its prolyl 4-hydroxylases. J. Biol. Chem. 279, 9899-9904. .
43.Mahon, P. C., Hirota, K. & Semenza, G. L. (2001) FIH-1: a novel protein that interacts with HIF-1alpha and VHL to mediate repression of HIF-1 transcriptional activity. Genes. Dev. 15, 2675-2686.
44.Mandl, M., Lieberum, M. K. & Depping, R. (2016) A HIF-1alpha-driven feed-forward loop augments HIF signalling in Hep3B cells by upregulation of ARNT. Cell. Death Dis. 7, e2284.
45.Semenza GL. (2013) HIF-1 mediates metabolic responses to intratumoral hypoxia and oncogenic mutations. J Clin Invest. 123(9):3664-3671.
46.Ravi R, et al. (2000) Regulation of tumor angiogenesis by p53-induced degradation of hypoxia-inducible factor 1alpha. Genes Dev 14:34-44.
47.David CJ, Chen M, Assanah M, Canoll P, Manley JL. (2010) HnRNP proteins controlled by c-Myc deregulate pyruvate kinase mRNA splicing in cancer. Nature 463: 364-368.
48.Christofk HR, Vander Heiden MG, Wu N, Asara JM, Cantley LC. (2008). Pyruvate kinase M2 is a hosphotyrosine-binding protein.Nature 452: 181-186.
49.Luo W, et al. (2011) Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1. Cell 145: 732-744.
50.Toffoli S, Michiels C. (2008) Intermittent hypoxia is a key regulator of cancer cell and endothelial cell interplay in tumours. FEBS J 275:2991-3002.
51.An WG, Kanekal M, Simon MC, Maltepe E, Blagosklonny MV, Neckers LM. (1998) Stabilization of wild-type p53 by hypoxiainducible factor 1alpha. Nature 392: 405-408.
52.Hammond EM, Giaccia AJ. (2005) The role of p53 in hypoxia induced apoptosis. Biochem Biophys Res Commun 331: 718-725.
53.Cai Z, Semenza GL. (2005) PTEN activity is modulated during ischemia and reperfusion: involvement in the induction and decay of preconditioning. Circ Res 97: 1351-1359.
54.Li X, et al. (2008) Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl Cancer Inst 100: 672-679.
55.Tubiana M, Koscielny S. (2008) On clonogenic tumour cells and metastasis-forming cells. Nat Rev Cancer 8: 990.
56.Kondoh H, et al.(2005) Glycolytic enzymes can modulate cellular life span. Cancer Res 65: 177-185.
57.Eng CH, Yu K, Lucas J, White E, Abraham RT. (2010). Ammonia derived from glutaminolysis is a diffusable regulator of autophagy.Sci Signal 3: ra31.
58.Koukourakis MI, Giatromanolaki A, Harris AL, Sivridis E. (2006) Comparison of metabolic pathways between cancer cells and stromal cells in colorectal carcinomas: a metabolic survival role for tumor-associated stroma. Cancer Res 66: 632-637.

