由于qPCR具有灵敏度高,特异性强,全封闭进行,减少操作造成的污染,自动化程度高等优势广泛用于基因表达研究领域。可以说是大多数实验汪在科研道路上需要做的实验,也是大部分实验数据的出处。
荧光定量PCR检测方法通常分为荧光染料法和探针法。染料法是一种DNA 小沟非饱和性结合染料,与DNA 结合时发光/ 不结合( 游离) 时不发光。每形成一条DNA 双链,就会有一定数量的染料结合上去,染料一旦与DNA 双链结合,就会产生荧光信号。探针法是一种水解探针(5’ Reporter, 3’ Quencher),探针完整时不发光/ 水解后发光。每形成一条DNA 双链,就会水解一条探针;每水解一条探针,就会产生一个单位荧光信号。
实时荧光定量PCR的优点
优点 :
当然,说了这么多,大家可能不以为意,一个protocol如此简单的实验有何惧哉,事实上,他矫情,事儿又多,喜怒无常,可能好多人经历过一天跑了不下6板,加样加到手抽筋,累到直不起腰,满脑子都是96孔板,要是碰上跑出来的结果ct值很高,复孔之间结果相差太大,白做了一天的实验,真是深受一万点暴击,这个世界对我太不友好了。
总结来说qPCR实验,其实和PCR差不多,只不过PCR关注的是扩增产量,而qPCR关注的起始模板数量。实验虽简单,却也马虎不得,任何细节都得注意,小编在这里给大家总结了几点容易忽视的地方:
► 1、熔解曲线出现多峰
引物设计不够优化:根据引物设计原则重新设计引物。
引物浓度太高:适当降低引物浓度。
►2、扩增曲线形状异常
扩增曲线不光滑:信号太弱,提高模板浓度并重复实验。
个别扩增曲线骤降:反应管内有气泡,由于温度升高后气泡破裂,使仪器检测到的荧光值突然降低所致。处理样本时要注意离心,加样过程中尽量避免吸打出气泡。
扩增曲线上飘:仪器测试默认基线设置为3至15个循环荧光值的标准差,可根据实际扩增情况进行相应基线调整。
► 3、反应结束无扩增曲线出现
反应循环数不够:一般设置循环数为40,但需注意的是过多的循环会增加过多的背景信号,降低数据可信度。
确认引物是否降解:长时间未用的引物应先通过PAGE电泳检测完整性,以排除引物降解的可能性。
确认程序中是否设置了信号采集步骤:两步法扩增程序一般将信号采集设置在退火延伸阶段;三步法扩增程序应当将信号采集设置在72℃延伸阶段。
模板浓度太低:减少稀释程度并重复实验。
模板降解:重新制备模板,重复实验。
预变性时间不足:本产品采用热启动的Taq酶,请确保按照反应程序设置的3 min预变性时间进行实际操作。
► 4、Ct值出现太晚
扩增效率极低:优化反应条件,重新设计引物。
模板浓度太低:减少稀释程度,重复实验。
模板降解:重新制备模板,重复实验。
PCR产物太长:一般将PCR产物长度设计为70~200 bp范围内。
反应体系中存在PCR反应抑制剂:一般为加入模板时带入,加大模板稀释倍数或者重新制备新的模板。
预变性时间不足:本产品采用热启动的Taq酶,请确保按照反应程序设置的3 min预变性时间进行实际操作。
► 5、阴性对照(NTC)出现明显扩增
反应体系或者水被污染:更换新的Buffer或者水进行重复实验。反应体系在超净工作台内配制,减少气溶胶污染。
引物二聚体的出现:一般在35个循环以后阴性对照出现扩增属正常情况,可配合熔解曲线进行分析。
► 6、重复性差
加样体积不准:使用性能较好的移液枪,扩大反应体系,增加组分加入体积。
定量PCR仪孔间温度不一致:定期校准仪器。
模板浓度太低:模板浓度越低,重复性越差,减少模板稀释度或提高加样体积。
阈值设置:对于不同板间的重复试验,请确保两次试验仪器阈值设置保持一致。
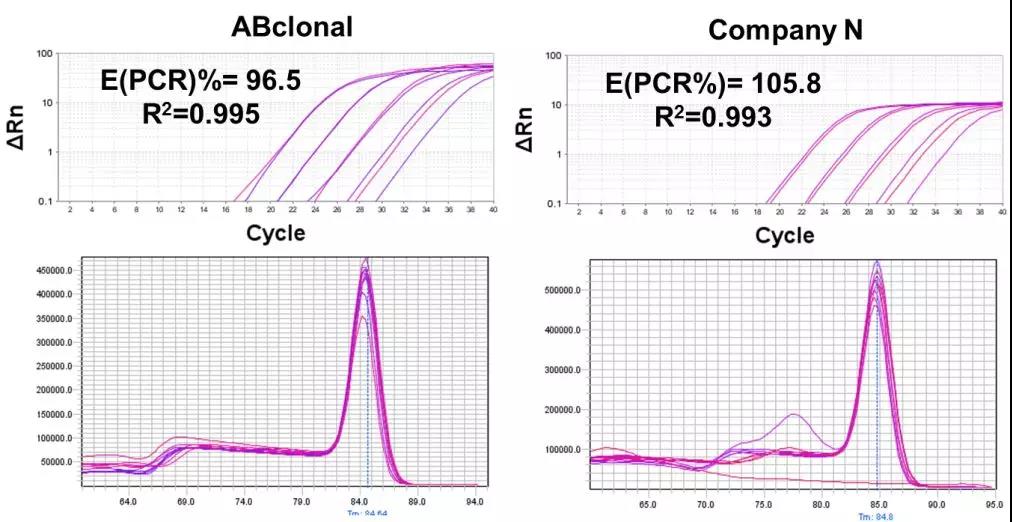
★ 1、采用自主设计的特殊参比染料,分辨率更为灵敏,并且适用于市面上所有的荧光定量PCR机型,数据可靠稳定。
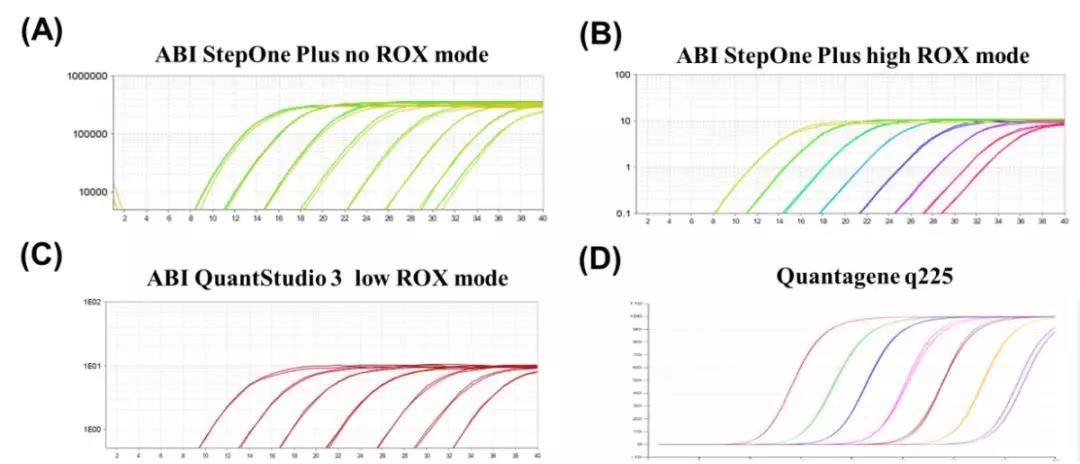
在不同的机型和ROX模式下使用特定的“120”引物扩增大肠杆菌的gDNA:(A)无ROX模式下ABI StepOne Plus上的qPCR结果; (B)高ROX模式下ABI StepOne Plus的qPCR结果; (C)低ROX模式下ABI QuantStudio 3的qPCR结果; (D)Quantagene q225的qPCR结果。
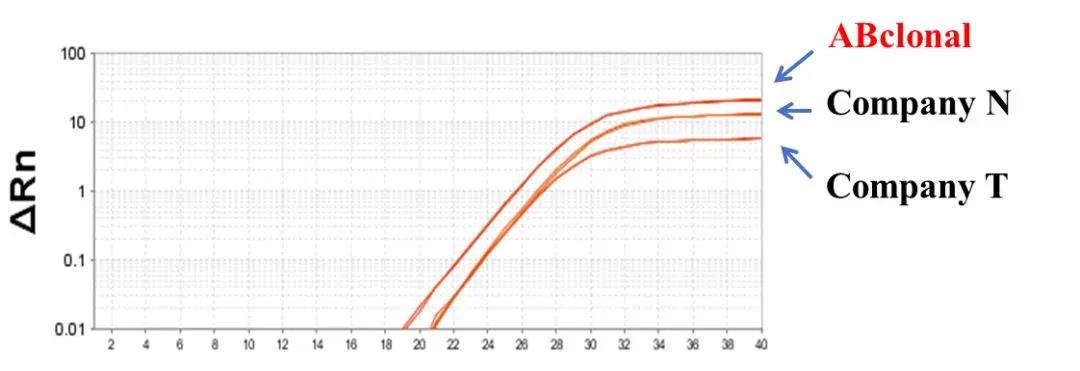
使用特异性“120”引物和ABclonal的2X Universal SYBR Green Fast qPCR Mix对大肠杆菌gDNA进行扩增。曲线图结果表明,ABclonal的产品具有更强,更灵敏的信号分辨率。
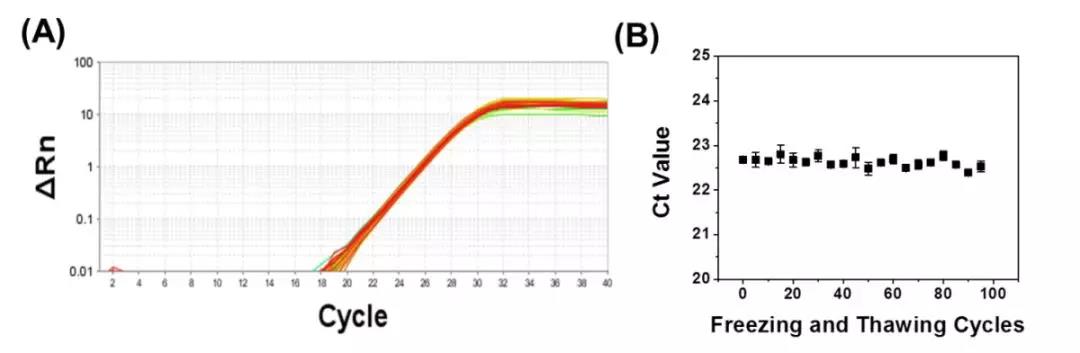
使用特异性“120”引物和ABclonal的2X Universal SYBR Green Fast qPCR Mix对大肠杆菌gDNA扩增。 曲线图结果表明,即使经过100次反复冻融, ABclonal产品仍能保持稳定扩增。
★ 2、采用热启动Taq酶进行扩增,在保证扩增效果的同时极大地提高了产品的特异性。
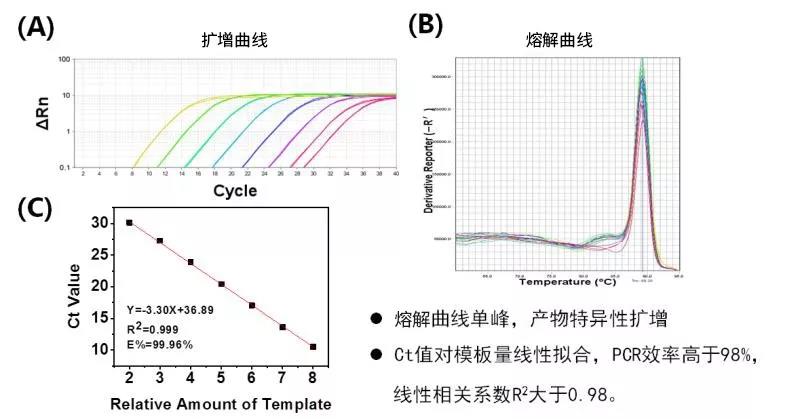
使用特异性“120”引物和ABclonal的2X Universal SYBR Green Fast qPCR Mix以及8个梯度10倍稀释模板起始量测试大肠杆菌gDNA得到的扩增曲线图(A)和熔解曲线(B); (C)对标准曲线的Ct值与相对模板量线性拟合,PCR效率达99.9%以上,线性相关系数(R2)达0.999。
★ 3、qPCR Mix的Buffer体系经过优化,产品适用于多个物种。
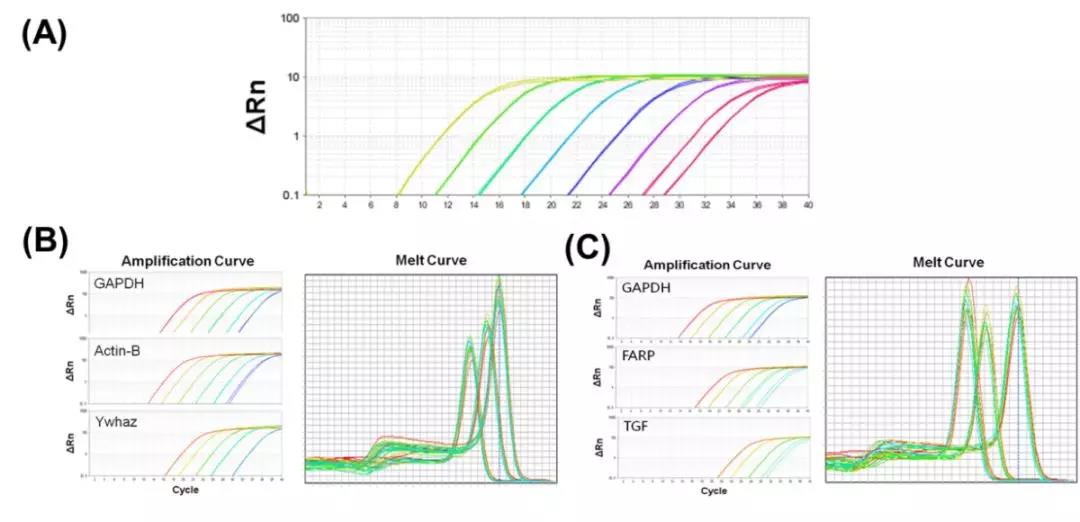
(A) 使用特异性“120”引物和ABclonal的2X Universal SYBR Green Fast qPCR Mix以及8个梯度10倍稀释模板起始量测试大肠杆菌gDNA得到的扩增曲线图; (B)使用特异性“GAPDH”,“Actin-B”和“Ywhaz”引物与ABclonal的2X Universal SYBR Green Fast qPCR Mix得到的大鼠cDNA扩增和熔解曲线图; (C)使用特异性“GAPDH”,“FARP”和“TGF”引物与ABclonal的2X Universal SYBR Green Fast qPCR Mix得到的兔cDNA的扩增和熔解曲线图。
>>>数据展示及竞品对比
小鼠 cDNA-GAPDH
模板投入:1.95 ng total RNA反转录产物,5个梯度10倍稀释
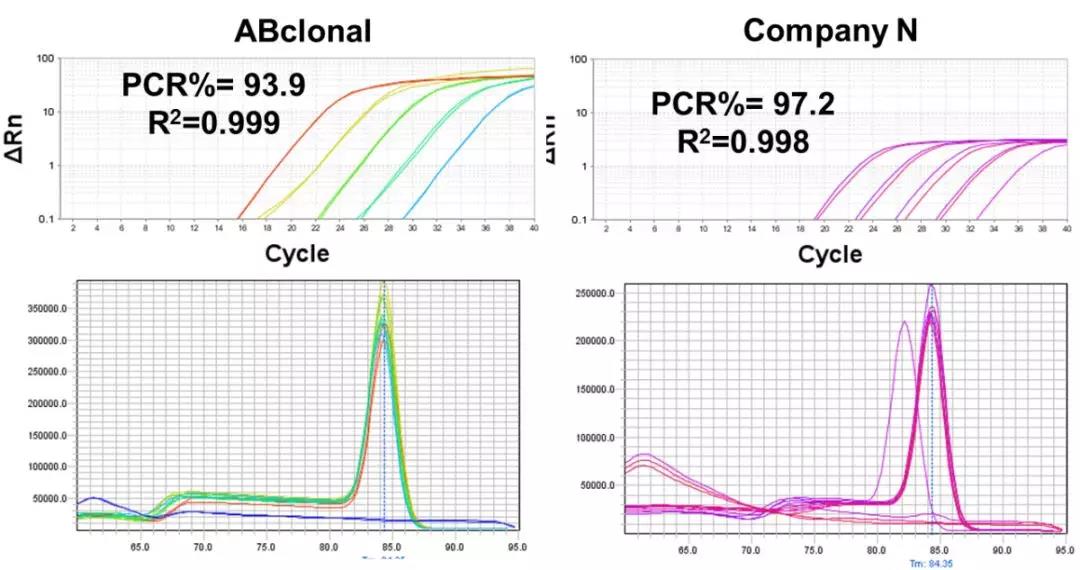
大鼠 cDNA-ARBP
模板投入:2.2 ng total RNA反转录产物,5个梯度10倍稀释